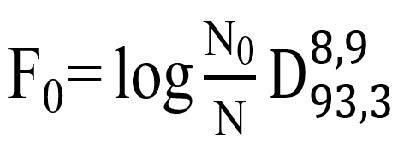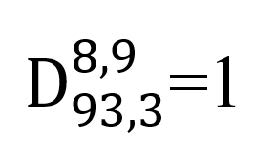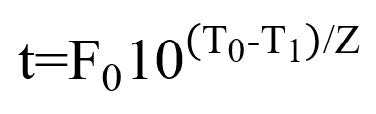Formulación
y evaluación de una compota de frutas tropicales enriquecida con harina
gelatinizada de quinua
Formulation and evaluation of a tropical fruit compote
enriched with gelatinized quinoa flour
Luis A. Taramona-Ruiz
Universidad Le Cordon Bleu. Lima, Perú
https://orcid.org/0000-0001-7670-3210
Cynthia K. Delgado-Huamán
Universidad Le Cordon Bleu. Lima, Perú
https://orcid.org/0009-0003-6236-6681
Maribel
M. Huatuco-Lozano
Universidad Le Cordon Bleu. Lima, Perú
https://orcid.org/0000-0001-6552-5252
Héctor E. Sánchez-Vargas
Universidad de Camagüey “Ignacio Agramonte Loynaz”. Camagüey,
Cuba
https://orcid.org/0000-0003-0640-6151
DOI: https://doi.org/10.36955/RIULCB.2024v11n2.003
Recibido: 06/01/2024
Revisado: 02/02/2024 Aceptado:
07/05/2024 Publicado: 30/06/2024
RESUMEN
La
compota es un alimento muy consumido entre la población infantil y un blanco
propicio para encontrar nuevas formulaciones que combatan la inseguridad
alimentaria y desnutrición infantil. El objetivo de este estudio fue evaluar alternativas de formulación y preparación de
compotas a base de frutas tropicales y harina gelatinizada de quinua. Las frutas empleadas fueron guayaba, mango y maracuyá. Se
desarrolló un diseño experimental de bloque completamente al azar con tres
tratamientos y 80 repeticiones. Los tratamientos empleados difieren únicamente
de la composición de la compota, con un procedimiento de elaboración común que
incluyó una operación de pasteurización por tratamiento térmico que garantizó
la inocuidad. Se evaluó sensorialmente el producto empleando una escala
hedónica facial; se realizaron ensayos fisicoquímicos, microbiológicos, así
como un análisis del valor nutricional que presenta la compota de mayor
aceptación. Se aplicó ANOVA con un valor estadístico p:<0,05 mediante el paquete
estadístico STATGRAPHICS. Las formulaciones fueron diferenciadas por las
concentraciones de guayaba y quinua: F1 (guayaba 55,77 %, harina de quinua
23,91 %), F2 (guayaba 63,74 %; harina de quinua 15,94 %) y F3 (guayaba 71,71 %;
harina de quinua 7,97 %); manteniendo para las tres formulaciones, en
proporciones similares el resto de los constituyentes compuestos por mango,
maracuyá, azúcar, ácido cítrico y vitamina C. La F3 fue la de mayor
aceptabilidad, al mismo tiempo que cumplió con los requisitos fisicoquímicos,
nutricionales y microbiológicos establecidos en las normas usadas como
referencia, de manera que se garantiza la calidad e inocuidad de la compota.
PALABRAS
CLAVE: Compota, guayaba, harina gelatinizada de
quinua, evaluación sensorial.
ABSTRACT
Compote is a widely consumed food among children and a
favorable target for finding new formulations that combat food insecurity and
child malnutrition. The objective of this study was to evaluate alternatives
for the formulation and preparation of compotes based on tropical fruits and
gelatinized quinoa flour (Chenopodium
quinoa). The fruits used were guava, mango and passion fruit. A completely
randomized block experimental design was developed with three treatments and 80
repetitions. The treatments used differ only in the composition of the compote,
with a common production procedure that included a pasteurization operation by
heat treatment that guaranteed safety. The product was sensory evaluated using
a facial hedonic scale; Physicochemical and microbiological tests were carried
out, as well as an analysis of the nutritional value of the most widely
accepted compote. ANOVA was applied with a statistical value p:<0.05 using
the STATGRAPHICS statistical software. The formulations were differentiated by
the concentrations of guava and quinoa: F1 (guava 55.77 %, quinoa flour 23.91 %),
F2 (guava 63.74 %; quinoa flour 15.94 %) and F3 (guava 71 .71 %; quinoa flour
7.97 %); maintaining for the three formulations, in similar proportions the
rest of the constituents composed of mango, passion fruit, sugar, citric acid
and vitamin C. F3 was the one with the greatest acceptability, at the same time
that it met the established physicochemical, nutritional and microbiological
requirements. in the standards used as a reference, so that the quality and
safety of the compote is guaranteed.
KEY WORDS: Compote, guava, gelatinized quinoa flour, sensory
evaluation.
INTRODUCCIÓN
La inseguridad alimentaria se ha identificado como uno
de los grandes problemas a nivel mundial. A finales del 2019, más de 135
millones de personas en 55 países y territorios se enfrentaban a una grave
inseguridad alimentaria y alrededor de 183 millones de personas se encontraban
en condiciones de seguridad alimentaria estresada, con riesgo elevado de caer
en la inseguridad alimentaria aguda (FAO, 2020 b). Esta difícil situación se ha agudizado con la
COVID-19 y la crisis alimentaria de la población mundial, afectada por una
subalimentación que afectaba antes de la pandemia a cerca de 800 millones de
personas en todo el mundo (WFP, 2017).
A
nivel global, el consumo de las partes comestibles de las plantas o sus
productos naturales ha experimentado un aumento significativo, impulsado por el
reconocimiento de sus beneficios nutricionales, como se señala en informes de
la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO, 2020a).
En consecuencia, la industria alimentaria ha dirigido considerable atención
hacia el desarrollo de productos bioactivos, utilizando pulpa y subproductos de
frutas (Rodrigues et al., 2021).
La
guayaba (Psidium guajava L.) es una de las frutas de mayor valor
nutricional y que ha sido ampliamente usada en la alimentación de los niños.
Esta fruta exhibe una notable adaptabilidad a diversas condiciones ambientales
y tiene en su composición alto contenido de vitaminas y minerales. Es
especialmente rica en vitamina C, la que cubre los requerimientos nutricionales
de los niños menores de 8 años (IICA, 2015).
También se le atribuyen propiedades medicinales debido a la presencia de
diversos metabolitos secundarios como benzofenonas, flavonoides, taninos,
triterpenoides y meroterpenoides (Zou y Liu, 2023).
De
igual manera, el mango (Mangifera indica L.), una fruta tropical de
consumo global presenta una rica composición de fitoquímicos, β-caroteno,
fibra, magnesio, potasio, vitamina A y C; así como, antocianinas y polifenoles,
como flavonoides y magniferina. Este componente confiere a la fruta propiedades
antioxidantes, antidiabéticas, anticancerígenas e inmunomoduladoras según
estudios recientes (Castro et al., 2023; Sabuz et al., 2023;
Stamper et al., 2023). Además de sus beneficios nutricionales, el mango
destaca por sus propiedades sensoriales, y sus derivados procesados abarcan una
amplia gama de productos, tales como jugos, néctares, pulpas, purés, compotas,
pieles de frutas, mermeladas, encurtidos, chutney, rodajas secas o trozos
enlatados (Marçal y Pintado, 2021).
El
maracuyá (Passiflora edulis) es una fruta ampliamente consumida,
caracterizada por su elevado valor nutricional debido a su composición: agua,
presente en mayor proporción en la cáscara (87 %). Los carbohidratos
constituyen una parte significativa en la cáscara, pulpa y semillas. Las
semillas contienen proteínas (13,2 % del peso seco) y lípidos (14,9 % del peso
seco) como ácido linoleico, linolénico, oleico, palmítico y esteárico. La
cáscara es notable por su elevado contenido de fibra (61,7 % del peso seco).
Además, la pulpa y el jugo del maracuyá son fuentes de vitamina C; mientras
que, las semillas y la cáscara aportan cantidades significativas de potasio,
cobre, magnesio, zinc, hierro, fenoles y cianidin-3-glucósido; así como,
carotenoides. Esta fruta se emplea en una variedad de preparaciones, como
aderezo en ensaladas, helados, postres, jugos, licores, ponches tropicales,
yogures, mermeladas y confitería. Las cáscaras tienen aplicaciones en la
producción de vino o té, como fuente de pectina, ingredientes medicinales, y
como parte de la alimentación animal. Las semillas prensadas en frío generan un
aceite de tonalidad amarillo pálido con un sabor suave y agradable, utilizado
tanto en la cocina como materia prima en la industria de pinturas y barnices
(Fonseca et al., 2022).
Entre
los componentes de mayor valor nutricional utilizados para suplementar las
compotas se destaca la quinua. Este pseudocereal ha sido potenciado por la FAO
debido a sus enormes potencialidades por su alto contenido en hidratos de
carbono, por contener todos los aminoácidos esenciales, oligoelementos y
vitaminas requeridas en la nutrición humana y no contener proteínas formadoras
de gluten (Dueñas, 2014 y Fundación PROINPA, 2011).
Mu
et al. (2023) en su estudio concluyeron que, la sustitución de harina de
trigo por harinas de quinua, puede ser una alternativa valiosa como ingrediente
en la producción de productos alimenticios funcionales. Esto se corrobora por
las notables cualidades funcionales y reológicas, las características
sensoriales y nutricionales; así como, por sus atributos fisicoquímicos.
Para
sentar las bases del diseño de un producto dirigido a la producción infantil es
necesario explorar la aceptabilidad que pudiera tener en dicho sector de la
población a partir de la evaluación de diferentes formulaciones. También se
necesita definir, con vistas al establecimiento de la tecnología de su
producción industrial, las condiciones de pasterización, almacenamiento y
conservación que garanticen su durabilidad y estabilidad, así como el
mantenimiento de sus propiedades nutricionales. En tal sentido, el objetivo de esta investigación, fue
la evaluación de alternativas de formulación y preparación de compotas a base
de frutas tropicales y harina gelatinizada de quinua que garanticen
aceptabilidad y adecuadas propiedades
nutricionales para la población infantil.
MATERIALES
Y MÉTODOS
Para
cumplir el objetivo de la investigación se diseñaron tres formulaciones con
diferentes proporciones de frutas y harina de quinua. El tratamiento para cada
una de las formulaciones fue el mismo, consistente en la elaboración de las
pulpas y las compotas, lo que incluye la pasteurización y el envasado. En la
tabla 1 se muestran las tres formulaciones evaluadas en esta investigación.
Tabla 1. Formulaciones experimentales de las
compotas
|
Materias primas
|
Formulaciones (% peso)
|
|
F1
|
F2
|
F3
|
|
Guayaba
|
55,77
|
63,74
|
71,71
|
|
Mango
|
5,00
|
5,00
|
5,00
|
|
Maracuyá
|
5,00
|
5,00
|
5,00
|
|
Harina de quinua
|
23,91
|
15,94
|
7,97
|
|
Azúcar
|
5,00
|
5,00
|
5,00
|
|
Agua
|
5,00
|
5,00
|
5,00
|
|
Ácido cítrico
|
0,07
|
0,07
|
0,07
|
|
Vitamina C
|
0,25
|
0,25
|
0,25
|
Cada
una de las tres formulaciones obtenidas fueron sometidas a una evaluación
sensorial que permitió determinar la formulación de mejor aceptación. A esta
última se le realizaron análisis físico-químicos y análisis microbiológico para
determinar su aptitud para el consumo y también se le realizó una valoración acerca
de las propiedades como compota, dirigidas a cubrir los requerimientos
nutricionales de la población infantil.
Los
ensayos físico-químicos fueron realizados midiendo un grupo de Requisitos contenidos
en la norma técnica ecuatoriana NTE INEN 2 009:95 “Alimentos colados y picados,
envasados para niños de pecho y niños de corta edad. Requisitos” Tomada del Servicio Ecuatoriado de Normalización
(INEN,1995)
que fue usada como referencia. Para realizar las determinaciones de los
requisitos se empelaron otras normas: AOAC 981.12 (pH), INEN 14 (sólidos
totales), AOAC 942.15 (acidez titulable) y la INEN 14 (vitamina C). Todos los
ensayos se realizaron por triplicado en el Laboratorio de la Sociedad de
Aseguramiento Técnico (SAT), Lima, Perú.
Los
ensayos microbiológicos fueron realizados para determinar el grado de
cumplimiento de los requisitos que establece la norma sanitaria peruana para la
calidad e inocuidad de los alimentos (MINSA, 2008).
Las determinaciones se realizaron inmediatamente después de terminado el
proceso de elaboración e incluyeron los aerobios mesófilos, mohos y levaduras, E.
coli y coliformes totales, así como Salmonella spp. Todos los
ensayos microbiológicos fueron realizados en el Laboratorio de Microbiología
del Organismo Nacional de Sanidad Pesquera – SANIPES, situado en la ciudad de
Lima en Perú.
Los
aerobios mesófilos fueron determinados usando el método descrito por el manual
de la Agencia Norteamericana para la regulación de Alimentos y Drogas, FDA por
sus siglas en inglés, específicamente el manual analítico bacteriológico dentro
de los métodos oficiales de análisis de la AOAC (FDA, 2001 a).
Por su parte las levaduras y mohos, según el compendio de métodos para los
exámenes microbiológicos de los alimentos (FDA, 2001 b ).
La
determinación de E. coli y Coliformes totales se realizó según la norma
internacional ISO 16649-3:2015 “Microbiology of the food chain- Horizontal
method for the enumeration of beta-glucoronidase-positive Escherichia coli-Part
3: Detection and most probable number technique using
5-bromo-4-chloro-3-indolyl-ß-D-glucuronide” (ISO, 2015),
mientras que para la determinación de salmonella se usó la norma peruana
NTP-ISO 6579-1:2019 “Microbiología de la cadena alimentaria. Método horizontal
para la detección, enumeración y serotipificación de Salmonella.Parte
1: Detección de Salmonella spp” (INACAL, 2019),
adoptada de la norma ISO de igual propósito.
La
evaluación sensorial se basó en un diseño experimental de bloque completamente
al azar (DBCA) con tres tratamientos y 80 repeticiones, que se corresponde con
el total de panelistas. Esta evaluación sensorial se realizó para determinar la
variabilidad de aceptación entre las diferentes formulaciones. Para tal fin se utilizó una escala hedónica
facial con cinco alternativas: Me desagradó (1), no me gustó (2), indiferente
(3), me gustó (4) y me encantó (5).
Las características organolépticas evaluadas fueron
color, olor y sabor. Los 80 panelistas fueron niños entre 6 y 8 años, que
degustaron la muestra de compota (25 g) por separado empleando una cuchara
plástica.
Los datos experimentales obtenidos fueron tabulados
y procesados con el paquete estadístico STATGRAPHICS. Se realizó la prueba ANOVA
para verificar si hubo diferencia significativa entre las formulaciones en
relación con las características organolépticas evaluadas.
La
formulación, la determinación de acidez titulable y la de vitamina C se realizaron
en el Laboratorio de la Universidad Nacional Federico Villareal de Lima. Los
análisis fisicoquímicos, en el Laboratorio de la Sociedad de Aseguramiento
Técnico (SAT), Lima. El análisis microbiológico, en el Laboratorio de
Microbiología del Organismo Nacional de Sanidad Pesquera – SANIPES, Lima, Perú
y la prueba sensorial se desarrolló en un colegio privado en Lima.
Para la elaboración de las pulpas de las frutas se
siguió el procedimiento de Martínez y Vásquez, (2021). Este incluye las
operaciones de: (1) Recepción y selección; (2) Lavado; (3) Troceado; (4)
Escaldado; (5) Licuado y (6) Tamizado. Esta última operación se realizó con el empleo
de un tamiz con perforaciones de 1 mm aproximadamente, con el que se separan la
pulpa de las semillas. El escaldado se realizó durante 10 minutos a una
temperatura de 75 °C.
A partir de la preparación de las
pulpas de frutas, la elaboración de la compota de fruta enriquecida con harina
gelatinizada de quinua se realizó siguiendo el diagrama de flujo que se
presenta en la Figura 1.
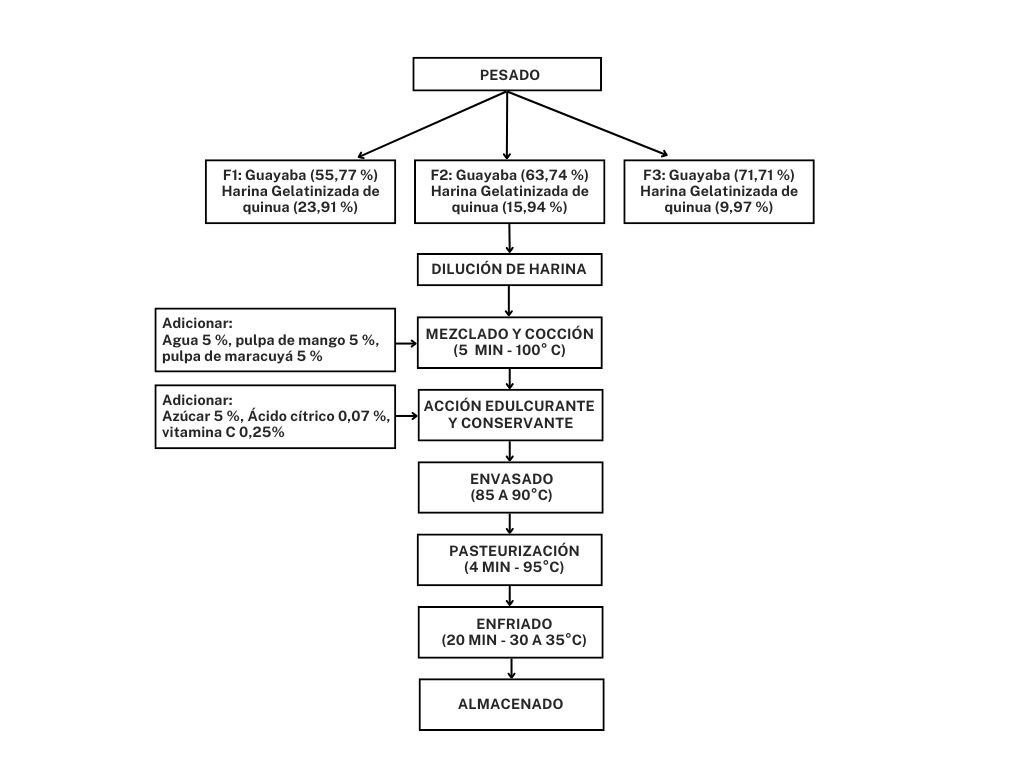
Fig.
1 Diagrama de flujo para la elaboración de la compota
Para establecer el régimen de pasteurización se tuvo
en cuenta que el producto a procesar (compota) es de alta acidez con un pH
entre 4,0 y 4,5; por lo que, se tomó como microorganismo de referencia al hongo
Byssochlamys fulva (Casusol,
2016; Encina-Zelada et al.,2013,
Bernal-Sánchez y Rojas-Hurtado, 2013; Guevara y Cancio, 2008; Pesantes y
Tejada, 2021) por su elevada resistencia
térmica a bajos valores de pH. Se empleó un tiempo de reducción decimal de un
minuto, que fue determinado a 93,3 ºC, y una constante de resistencia térmica (Z)
de 8,9 ºC (Stumbo,
1973).
Estableciendo
como premisa la reducción de la carga microbiana en cinco unidades decimales
logarítmicas
=5), se determinó el efecto letal de la
pasteurización (
)
a partir de la siguiente ecuación:
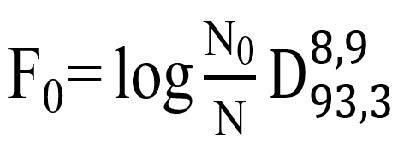
Donde:
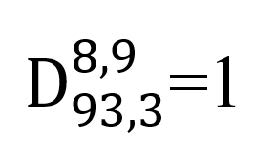 =1 - tiempo de reducción
decimal (min)
=1 - tiempo de reducción
decimal (min)
Para determinar el tiempo de pasteurización a la
temperatura de 95 º C (T1), se empleó la ecuación:
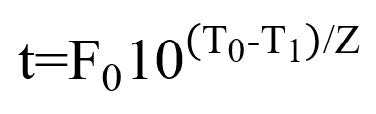
En este caso, T0 es la temperatura de
referencia a la que se determinó el tiempo de reducción decimal (D).
El contenido nutricional de la compota de mayor
aceptación se realizó sobre la base de 100 g de compota y a partir de tablas de
composición de alimentos en relación con energía (kcal), proteínas (g), grasa
(g), carbohidratos totales (g), fibra dietaria (g), calcio (mg), hierro (mg) y
vitamina C (mg).
RESULTADOS
Y DISCUSIÓN
En la Tabla 2 se muestran los resultados de la
evaluación sensorial que determinó la aceptabilidad de las características
organolépticas (color, sabor y olor) de las tres formulaciones según
escala hedónica facial. Este resultado expresa porcentualmente la calificación
otorgada para cada atributo y formulación.
Se puede observar que la mayoría de los panelistas
tuvieron una reacción de rechazo (“Me desagradó y “no me gustó”) para los tres
atributos evaluados en la formulación F1, mientras que las categorías “no me
gustó” e “indiferente” fueron las más prevalentes en la F2. Para estas dos formulaciones
los panelistas no otorgaron en ningún caso categorías de “me gustó” y “me
encantó”
Tabla 2. Aceptabilidad de las características
organolépticas (color, sabor y olor) de las diferentes formulaciones según
escala hedónica facial
|
Escala hedónica facial
|
F1
|
F2
|
F3
|
|
color
|
sabor
|
olor
|
color
|
Sabor
|
Olor
|
color
|
sabor
|
olor
|
|
Me desagradó
|
52,5
|
51,25
|
53,75
|
---
|
---
|
1,25
|
---
|
---
|
---
|
|
No me gustó
|
45,0
|
48,75
|
43,75
|
60,0
|
51,25
|
40,0
|
---
|
---
|
---
|
|
Indiferente
|
2,50
|
---
|
2,50
|
40,0
|
48,75
|
58,75
|
---
|
---
|
---
|
|
Me gustó
|
---
|
---
|
---
|
---
|
---
|
---
|
16,25
|
55,0
|
46,25
|
|
Me encantó
|
---
|
---
|
---
|
---
|
---
|
---
|
83,75
|
45,0
|
53,75
|
Para la formulación F3 la mayor cantidad de
respuestas se ubicaron para el color y olor en la categoría “me encantó” y para
el sabor, “me gustó”. Hubo diferencia significativa entre sabor y color, olor y
color (p:<0,05) en la F3 al comparar con las otras formulaciones. Las Pruebas de Múltiples Rangos realizada empleando el paquete estadístico STATGRAPHICS permitió determinar que
cada una de las formulaciones pertenecen a diferentes grupos homogéneos.
A partir de los resultados del análisis estadístico
queda demostrado que existe diferencia significativa entre las formulaciones en
cada una de las tres características de color, sabor y olor, siendo la
formulación F3, con 71,71 % de guayaba y 7,97 % de harina gelatinizada de
quinua la que más aceptación tuvo entre los panelistas.
La
evaluación sensorial realizada y la mayor
aceptación de la formulación F3, revelan la
predilección de los infantes por
compotas con alta proporción de guayaba. Esta formulación
alcanzó el 100 % de
la calificación dentro de las categorías “me
gustó” y “me encantó”, resultado
superior
al alcanzado por Berdugo et al. (2021),
que desarrollaron un alimento destinado a niños, elaborado con mango (Mangifera
indica L.) y moringa (Moringa oleifera Lam), con resultados que
oscilaron entre el 68 % y el 88 % de aceptación en los atributos evaluados, que
incluyeron color, sabor, olor y textura.
La Tabla 3 reporta los indicadores fisicoquímicos
para la formulación de mayor aceptación (F3). Los resultados de los ensayos muestran
poca dispersión para las tres réplicas y los tres indicadores.
Tabla 3. Indicadores fisicoquímicos para la
formulación seleccionada
|
Réplica
|
pH
|
° Brix
|
% de acidez (mg/100mL)
|
|
1
|
4,01
|
20
|
0,195
|
|
2
|
4,00
|
22
|
0,195
|
|
3
|
4,00
|
21
|
0,195
|
|
Promedio
|
4,00
|
21
|
0,195
|
Los valores de pH y acidez indican que la formulación
aceptada (F3) tiene un carácter ligeramente ácido. A partir de estos resultados
y de la comparación con los obtenidos por otros autores, se constató que
los valores de pH y Brix (sólidos solubles) fueron inferiores a los
evidenciados por Cardona y López (2020), quienes desarrollaron tres compotas:
ahuyama (pH= 6,8 y 31,8 Brix), zanahoria (pH= 7,4 y 30,5 Brix) y breva (pH= 6,2
y 18,0 Brix). Aunque se han observado estas diferencias en cuanto a pH y
sólidos solubles, estos indicadores son cumplidos por la formulación aceptada al
tomar como referencia la norma ecuatoriana NTE INEN 2 009:95, que exige un pH
por debajo de 4,5 y un total de sólidos solubles por encima de 15 % peso.
También
cumplen con la norma de referencia, con resultados muy similares a los de la
formulación aceptada en cuanto a los indicadores fisicoquímicos,
las compotas elaboradas por Tiaga y colaboradores (2021), quienes emplearon camote
morado y blanco, combinados con piña (Ananas comosus) y banano (Musa
x paradisiaca). En este caso se obtuvieron valores de pH de 4,38 y 4,28
para las compotas de camote morado y blanco, respectivamente. En cuanto al
contenido de sólidos solubles, la compota de camote morado presentó un valor promedio
de 22,43 °Brix mientras que, la compota de camote blanco mostró un valor
promedio de 8,56 °Brix. Esta diferencia podría atribuirse a la mayor cantidad
de azúcar presente en el camote morado. Es importante destacar que, según el
Codex Alimentarius (FAO, 2022), las compotas endulzadas deben contener un
mínimo de sólidos solubles, no inferior al 16,5 % de sólidos solubles totales
(16,5 °Brix), valor muy cercano al de la norma ecuatoriana y que también es
cumplido por la formulación F3.
Los resultados de los ensayos microbiológicos de la
formulación seleccionada se muestran en la Tabla 4. En ella se observa el
cumplimiento de la norma NTS N° 071- MINSA/DIGESA para cada uno de los agentes
microbianos ensayados.
Tabla 4. Resultados de los análisis microbiológicos
de la formulación seleccionada
|
Análisis de agentes Microbianos
|
Resultado después de la
elaboración
|
Referencia Límite máx. (ufc/mL)
*
|
|
Aerobios mesófilos
|
< 250 ufc/g
|
104
|
|
Mohos y levaduras
|
<10 ufc/g
|
102
|
|
E. coli y coliformes totales
|
0 NMP/g
|
10
|
|
Salmonella spp
|
no detectado /25 g
|
Ausencia/25
|
*Norma NTS N° 071- MINSA/DIGESA
Estos resultados mostrados en la tabla 4, que
determinan la calidad microbiológica de la compota, están altamente condicionados
por el método de pasteurización empleado y descrito en la metodología. Después
de tomar como referencia un organismo de alta resistencia térmica a bajos
valores de pH (hongo Byssochlamys fulva), así como el tiempo de
reducción decimal (D) y la constante de resistencia térmica (Z),
característicos del mismo, el tiempo de pasteurización calculado fue de 3,22
minutos, tomado como 4 minutos para los efectos prácticos según se muestra en
la tecnología de elaboración de la compota representada en el diagrama de flujo
(Figura 1).
El
método de pasteurización empleado, con un bajo tiempo de exposición al agente calefactor,
no solo garantizó un producto final inocuo, sino que también tuvo un impacto negativo
mínimo en la calidad sensorial de la compota, refrendado por la aceptación
positiva del panel evaluador. De igual manera, por esta misma razón, es
previsible también el mantenimiento de la calidad nutricional de los
ingredientes y su influencia positiva en el valor nutricional de la compota que
se evalúa. Este valor
nutricional se reporta en la Tabla 5.
Tabla 5. Valor nutricional de la formulación más
aceptada
|
Nutrientes
|
Valor nutricional
|
|
Energía (Kcal)
|
86,38
|
|
Carbohidratos totales (g)
|
14,79
|
|
Proteínas (g)
|
1,64
|
|
Grasas (g)
|
0,95
|
|
Fibra dietaria (g)
|
4,71
|
|
Calcio (mg)
|
23,73
|
|
Hierro (mg)
|
1,03
|
|
Vitamina C (mg)
|
131,84
|
Nota: por cada 100 g de peso
En
cuanto al contenido nutricional, la compota seleccionada (F3) mostró ser especialmente rica en vitamina C,
con 131,84 mg/100 g, algo atribuido a la presencia significativa de guayaba en
su composición, fruta que es cuatro veces más rica en esa vitamina que la
naranja Zou y Liu (2023). Esta concentración de
vitamina C está muy por encima de los requerimientos nutricionales de los niños
entre seis y 24 meses de 50 mg/día (OPS, 2003).
La
formulación estudiada es también rica en calcio, hidratos de carbono y
proteínas debido al importante aporte de la quinua. Esta última garantiza la
existencia en la formulación de todos los aminoácidos esenciales para la
nutrición humana, así como una concentración de proteínas en la compota de 1,64
g/100 g. El contenido calórico, por encima de 85 kcal/100 g también se
considera adecuado al superar otras compotas de referencias (Aldana et al.,
2018).
CONCLUSIONES
Las
tres formulaciones de compotas evaluadas, que fueron elaboradas a base de pulpa
de guayaba y harina de quinua, tienen diferencias estadísticamente
significativas en cuanto a sabor, color y olor con un nivel de confianza del
95,0 %. La más aceptada de estas formulaciones es la codificada como F3, que
posee un 71,71 % de guayaba y 7,97 % de harina gelatinizada de quinua.
La
formulación más aceptada según los resultados de la evaluación sensorial (F3)
cumple con los parámetros físico-químicos establecidos en la norma técnica
ecuatoriana NTE INEN 2 009:95, usada como referencia para establecer los
requisitos de productos dirigidos a niños de pecho y de corta edad. Esta
formulación posee una composición que cubre los requerimientos nutricionales de
los niños entre seis y 24 meses de edad, por lo que constituye una alternativa
para garantizar una adecuada nutrición infantil.
El
proceso tecnológico empleado para la elaboración de las pulpas de frutas y la
compota garantiza los requisitos microbiológicos que establece la norma
sanitaria peruana para la calidad e inocuidad de los alimentos (MINSA, 2008).
REFERENCIAS
BIBLIOGRÁFICAS
- Casusol,
K. (2016). Formulación de una salsa picante a base de pulpa de cocona (Solanum
sessiliflorum), aji amarillo (Capsicum baccatum) y ají charapita (Capsicum
Chinense). [Tesis para el título de Industrias Alimentarias, Universidad Le
Cordon Bleu]. Repositorio de la Universidad Le Cordon Bleu https://repositorio.ulcb.edu.pe/handle/ULCB/20
- Dueñas,
D. M. (2014). Vigilancia competitiva de la quinua: potencialidad para el
departamento de Boyacá. SUMA DE NEGOCIOS, 5(12), 85-95. https://doi.org/10.1016/S2215-910X(14)70030-8
- Encina,
C., Bernal, A., y Rojas, D. (2013). Efecto de la temperatura de pasteurización
y proporción de mezclas binarias de pulpa de carambola y mango sobre su
capacidad antioxidante lipofílica. Ingeniería
Industrial, 31(31),
197-219. https://doi.org/10.26439/ing.ind2013.n031.23
- Food and Drug Administration. (2001 a). AOAC. Aerobic
Plate Count. In Bacteriological Analytical Manual on Line. https://www.fda.gov/food/laboratory-methods-food/bacteriological-analytical-manual-bam
- Food
and Drug Administration. (2001 b). Compendium of Methods for the
Microbiological Examination of Foods. In Yeasts and Molds. https://www.fda.gov/food/laboratory-methods-food/bam-chapter-18-yeasts-molds-and-mycotoxins
- Fundación
PROINPA. (2011). La quinua: cultivo
milenario para contribuir a la seguridad alimentaria mundial.
https://www.proinpa.org/web/
- Guevara,
A., y Cancio, K. (2008). Métodos apropiados que conducen a una inactivación o a
un control de la carga microbiana.
- Instituto
Interamericano de Cooperación para la Agricultura (2015). Caracterización del
valor nutricional de los alimentos https://repositorio.iica.int/bitstream/handle/11324/8160/BVE19040273e.pdf?sequence=1&isAllowed=y
- Instituto
Nacional de Calidad. (2019). NTP-ISO 6579-1:2019 Microbiología de la cadena
alimentaria. Método horizontal para la detección, enumeración y
serotipificación de Salmonella. Parte 1: Detección de Salmonella spp. In
(pp. 87). Lima, Perú. https://www.sanipes.gob.pe/archivos/ensayos_aptitud/Deteccion-de-Salmonella-SPP-2020-I.pdf
- Instituto
Nacional de Enfermedades Neoplásicas. (1995). NTE INEN 2 009:95 Alimentos
colados y picados, envasados para niños de pecho y niños de corta edad.
Requisitos. In (pp. 11). Quito, Ecuador. https://es.scribd.com/document/694459291/inen-2009-95
- International
Organization for Standardization. (2015). ISO 16649-3:2015 Microbiology of the food chain-
Horizontal method for the enumeration of beta-glucoronidase-positive
Escherichia coli-Part 3: Detection and most probable number technique using
5-bromo-4-chloro-3-indolyl-B-D-glucuronide. In
(pp. 18). Ginebra, Suiza. https://www.iso.org/standard/56824.html
- Ministerio
de Salud. (2008). 071-MINSA/DIGESA-V. 01. 2008. Norma sanitaria que establece
los criterios microbiológicos de calidad sanitaria e inocuidad para los
alimentos y bebidas de consumo humano. Resolución Ministerial (591-2008). https://www.saludarequipa.gob.pe/desa/archivos/Normas_Legales/alimentos/RM591MINSANORMA.pdf
- Organización
de las Naciones Unidas para la Agricultura y la Alimentación (FAO. (2020 a)).
Frutas y verduras – esenciales en tu dieta. Documento de antecedentes. Roma. https://doi.org/10.4060/cb2395es
- Organización
de las Naciones Unidas para la Agricultura y la Alimentación. (2020 b).
Principales iniciativas de la Red mundial contra las crisis alimentarias para
evitar una catástrofe alimentaria durante la pandemia de COVID-19. https://www.un.org/es/global-issues/food
- Organización
Panamericana de la Salud. (2003). Principios de orientación para la
alimentación complementaria del niño amamantado. https://iris.paho.org/handle/10665.2/49259
- Pesantes,
G. C., y Tejada, S. E. (2021). Capacidad antioxidante y compuestos bioactivos
en el proceso de elaboración de zumo de arándanos (Vaccinium corymbosum).
[ Tesis de maestría en Ciencia y tecnología de los Alimentos Universidad Nacional del Callao, Perú]
Repositorio de la Universidad Nacional de Callao https://repositorio.unac.edu.pe/handle/20.500.12952/5519
- Programa
Mundial de Alimentos. (2017). Plan Estratégico del Programa Mundial de
Alimentos para 2017-2021. https://executiveboard.wfp.org/document_download/WFP-0000037199
- Stumbo,
R. (1973). Thermobacteriology in food processing (A. Press Ed.). Editorial: Elsevier. https://shop.elsevier.com/books/thermobacteriology-in-food-processing/stumbo/978-0-12-675352-3