Esta obra está bajo licencia internacional Creative Commons Reconocimiento 4.0
Recibido: 01/08/2020 Revisado: 08/08/2020 Aceptado: 10/08/2020 Publicado: 25/10/2020
Como corresponsales de guerra, los investigadores enfrentan el reto de reportar a diario el enfrentamiento al SARS-CoV-2, virus que ha puesto en vilo la salud pública y la estructura socio-económica de prácticamente todos los países. Normas básicas de higiene y el aislamiento social son valiosas armas en el plan estratégico de este combate. No obstante, para limitar la propagación del virus y manejar la enfermedad que este produce (COVID-19), es táctico comprender el rol dual de la respuesta inmune en los individuos infectados. Por una parte, los actores moleculares y celulares del sistema inmune son, sin duda, determinantes en el control de la infección y la replicación viral; pero, por otra parte, también se ha evidenciado su contribución a la severidad y mortalidad por COVID-19. En consecuencia, el diseño e implementación de estrategias de inmunoterapia para manipular al sistema inmune, así como la identificación de biomarcadores inmunológicos con valor pronóstico, son una prioridad en la prevención y manejo de esta enfermedad. La experiencia acumulada y las oportunidades que ofrece la ingeniería genética en el diseño de plataformas vacunales y otras terapias biológicas, son determinantes. Sin embargo, las etapas y plazos de tiempo que regularmente requieren el desarrollo de estos productos, no son compatibles con la necesidad de controlar la pandemia en el menor plazo de tiempo posible. ¿Qué riesgos enfrentamos cuando una pandemia nos fuerza a modificar la estrategia de desarrollo de un arma terapéutica? El presente trabajo abordará la relevancia de la inmunoterapia contra SARS-CoV-2 y los retos de su desarrollo en medio de esta guerra.
Palabras clave: Infección por coronavirus, sistema inmunológico, inmunoterapia, desarrollo de medicamentos, pandemia y COVID-19.
ABSTRACT
As war correspondents, investigators face the challenge of reporting on a daily basis the confrontation with SARS-CoV-2, a virus that has put public health and the socio-economic structure of virtually all countries at collapse edge. Basic rules of hygiene and the social isolation are valuable weapons in the strategic plan of this battle. However, to limit the spread of the virus and manage the disease it produces (COVID-19), it is tactical to understand the dual role of the immune response in infected individuals. On the one hand, the molecular and cellular actors of the immune system are, without a doubt, determining factors in the control of infection and viral replication; on the other hand, its contribution to COVID-19 severity and mortality has also been evidenced. Consequently, the design and implementation of immunotherapy strategies to manipulate the immune system, as well as the identification of immunological biomarkers with prognostic value, are a priority in the prevention and management of this disease. The accumulated experience and also the opportunities offered by genetic engineering in the design of vaccination platforms and other biological therapies, are determining factors. However, the stages and time frames that regularly require the development of these products are not compatible with the rapid control of this pandemic. What risks do we face when a pandemic forces us to modify the development strategy of a therapeutic weapon? This paper addresses the relevance of immunotherapy against SARS-CoV-2 and the challenges of its development in the middle of this war.
Keywords: Coronavirus infections, immune system, immunotherapy, drug development, pandemic and COVID-19.
INTRODUCCIÓN
El SARS-CoV-2 es un coronavirus, cuyo material genético es un Ácido Ribonucleico (ARN) de simple cadena, con una elevada capacidad infectiva (Quiroz et al., 2020). Esta afirmación se valida al revisar los reportes oficiales de la Organización Mundial de la Salud (OMS) donde se reporta que, en poco más de ocho meses, cerca de 20 millones de personas de prácticamente todos los países del mundo han sido diagnosticados con la enfermedad que el SARS-CoV-2 produce: la COVID-19 (OMSa, 2020). Los coronavirus responsables del Síndrome Respiratorio Agudo Grave (SARS, de sus siglas en inglés) y del Síndrome Respiratorio de Oriente Próximo (MERS, de sus siglas en inglés) producen cuadros clínicos más graves que el SARS-CoV-2 (Paules et al., 2020). Aunque la letalidad reportada para estos síndromes es mayor que la de SARS-CoV-2 (Prompetchara et al., 2020), su impacto social y sobre los sistemas de salud resultó significativamente menor, pues ambos virus tuvieron una expansión más limitada. A pesar de las medidas básicas de contención implementada por los gobiernos y los sistemas de salud, la OMS declaró una situación de emergencia sanitaria pandémica. En este contexto, las instituciones académicas, las empresas farmacéuticas y biotecnológicas, y consorcios financieros, como la Coalición de Innovaciones en Preparación para las Epidemias (CEPI, de sus siglas en inglés), han implementado diversas estrategias para impulsar la inmunoterapia en el manejo de la infección con SARS-CoV-2 (Lurie et al., 2020).
La inmunoterapia es un concepto moderno, que incluye no solo la estimulación y el ¨entrenamiento¨ de la respuesta inmune para inmunizar contra las infecciones (vacunología), sino que abarca todas las alternativas de manipulación de la respuesta inmune con el fin de tratar enfermedades crónicas como el cáncer, los síndromes neurodegenerativos, la autoinmunidad, la hipersensibilidad, y otras (Wraith, 2017). Las diversas estrategias de inmunoterapia (y farmacológicas en general) que se encuentran actualmente en investigación clínica para el manejo de la COVID-19, se registran en la Plataforma de Registro Internacional de Ensayos Clínicos de la OMS, y se procesan por un equipo internacional de investigadores encargados de ordenarlas, mapearlas y detallarlas sistemáticamente, para su revisión por la comunidad científica internacional, en un formato gráfico altamente interactivo (Boutron et al., 2020).
La pandemia por SARS-CoV-2 ha llevado a plantear un interesante abordaje de la inmunoterapia, en el que se impulsan en paralelo alternativas que buscan, tanto inmunizar a la población, como manejar los síntomas que la COVID-19 produce. Lo anterior es consecuencia de dos razones fundamentales: la primera, el conocimiento de las características de la respuesta inmune frente al virus, lo cual permite potenciar los mecanismos efectores de la respuesta antiviral (Vabret et al., 2020); la segunda, la evidencia de que, la desregulación de la respuesta inmune en los pacientes con COVID-19 puede producir una respuesta inflamatoria que condiciona el curso clínico de la enfermedad y su mortalidad (Abdin et al., 2020; Yajing et al., 2020).
El desarrollo de la biotecnología y la ingeniería genética, así como la capacidad de manipular la respuesta inmune, con herramientas del propio sistema inmune (ej. citocinas, anticuerpos), ofrece una sólida plataforma para que la inmunoterapia se posicione entre las alternativas para el manejo de esta enfermedad. Sin embargo, hay un reto que no se debe menospreciar: el hecho de que todo este abordaje se construye en el contexto de una pandemia. Lo anterior implica que se deformen tanto los plazos de tiempo, como las necesidades financieras y logísticas, la divulgación de información científica (y la muy poco científica) y la presión social, que acompañan el desarrollo de estas terapias en una situación epidemiológica de emergencia sanitaria.
Estos aspectos guiarán el contenido del presente trabajo, que recorre la respuesta inmune contra el SARS-COV-2, los resultados alcanzados por las diferentes alternativas de inmunoterapia en investigación clínica, los mediadores de la respuesta inmune como biomarcadores en el diagnóstico y pronóstico de la COVID-19, así como los retos que impone la situación de pandemia a la investigación clínica y el registro de los medicamentos, para combatir esta enfermedad a escala mundial.
DESARROLLO
I. Respuesta inmune antiviral
La respuesta inmune antiviral, incluyendo la inducida tras la infección con el SARS-CoV-2, involucra diversos actores celulares y moleculares de la respuesta inmune, tanto del sistema innato como del adaptativo (Vabret et al., 2020). La eficacia de la misma depende de factores propios del hospedero (edad, condición de salud, estado nutricional, predisposición genética) o del virus propiamente (vía de entrada al organismo, mecanismo de infección celular, estrategia de escape a la vigilancia inmunológica). En general, estos mecanismos se pueden dividir en dos categorías: 1) los que limitan la infección celular y la replicación viral; 2) los que eliminan a las células infectadas (Figura 1).
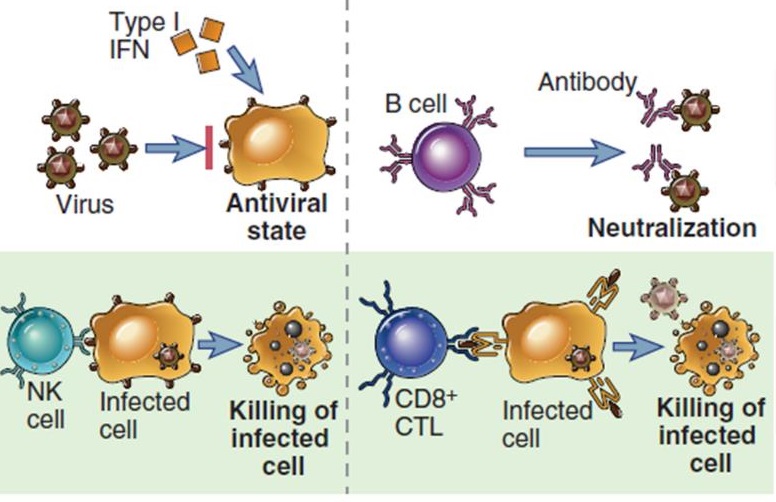
Figura 1. Mecanismos moleculares y celulares de la respuesta inmune, innata y adaptativa, involucrados en el control de la infección viral y la eliminación de las células infectadas. Tomado y modificado de Abbas et al., 2017
Los interferones tipo I y tipo III (IFNs), y los anticuerpos, contribuyen a inhibir la replicación y la infección viral, respectivamente. Los primeros, están constituidos por diversas moléculas secretadas como resultado de la respuesta inmune innata. Los segundos, son glicoproteínas producidas por los linfocitos B. Estas células son componentes de la respuesta inmune adaptativa, que al reconocer los antígenos virales se diferencian a células plasmáticas con elevada capacidad secretora.
Los IFNs tipo I y tipo III provocan la degradación del mARN viral, inhibición de la síntesis de proteínas virales y el ensamblaje de los viriones (Ivashkiv y Donlin, 2014). La secreción de los IFNs tipo I y tipo III se produce como resultado del reconocimiento de patrones moleculares asociados a los patógenos (PAMPs, de sus siglas en inglés), por receptores poco diversos y poco específicos conocidos como receptores de patrones moleculares. Entre estos receptores resaltan los llamados Receptores tipo Toll (TLR, de sus siglas en inglés), ubicados en la membrana plasmática o endosomas intracelulares (Li et al., 2020; Prompetchara et al., 2020). Como muestra la Figura 2A, los TLRs ubicados a nivel intracelular (ej. TLR 3 y TLR7) reconocen como PAMPs al material genético de los virus. Es importante resaltar, que en pacientes con la COVID-19, se ha descrito la deficiente producción de IFNs tipo I, en comparación con lo inducido por infecciones con los virus SARS-CoV y MERS (Mantloa et al, 2020; Hadjadj et al., 2020). Además de la secreción de IFNs, la activación de los TLRs favorece la secreción de mediadores de la inflamación, como las citocinas IL6 e IL1β, cuya relevancia en la inmunopatogenia del SARS-CoV-2 se retomará más adelante.
Por otra parte, para que se produzca la secreción de anticuerpos, los linfocitos B deben reconocer los antígenos virales con su Receptor de Células B (BCR, de sus siglas en inglés). Los BCR son altamente específicos y reconocen los antígenos con alta afinidad. Estos receptores se distribuyen de manera clonal, de modo que varios clones de linfocitos B se activan y diferencian a células plasmáticas ante la presencia de un virus, lo que produce una respuesta policlonal de anticuerpos. Los anticuerpos pueden ser de cinco clases diferentes, siendo los IgM, IgG e IgA los más relevantes en la respuesta contra SARS-CoV-2. Al reconocer los virus, los anticuerpos neutralizan su capacidad infectiva y favorecen su remoción, al estimular la fagocitosis mediada por otras células del sistema inmune innato: los macrófagos y los neutrófilos.
Además de su capacidad fagocítica, los macrófagos y los neutrófilos secretan diversas moléculas muy importantes para la comunicación intercelular, como las ya mencionadas citocinas. Las funciones de las citocinas son muy diversas, incluyendo aquellas con actividad pro-inflamatoria como la IL6 (Hunter y Jones, 2015), la IL1 (Dinarello, 2018) y el TNFα (Esposito y Cuzzocrea, 2009). El efecto de estas citocinas puede ser local (en los tejidos infectados) y/o sistémico (ej. leucocitosis, fiebre, incremento de la proteína C reactiva). El contexto inflamatorio que estas citocinas produce, contribuye al reclutamiento, al sitio de la infección, de linfocitos del sistema inmune innato con capacidad citotóxica. Estos son llamados asesinos naturales (NK, de sus siglas en inglés), los cuales reconocen a las células infectadas e inducen su muerte por apoptosis.
Una segunda población de linfocitos también contribuye a la muerte por apoptosis de las células infectadas: los linfocitos T citotóxicos. En general, los linfocitos T pertenecen al sistema inmune adaptativo (al igual que los linfocitos B) y se dividen en dos subpoblaciones: los linfocitos T auxiliadores (expresan en la membrana plasmática la molécula CD4) y los linfocitos T citotóxicos (expresan en la membrana plasmática la molécula CD8). Ambas subpoblaciones, antes de reconocer los antígenos, residen fundamentalmente en los órganos linfoides secundarios (ganglios linfáticos y bazo). A estos órganos linfoides llegan las células dendríticas maduras para mostrar los antígenos virales a los linfocitos T (presentación de antígenos). Para ello, las células dendríticas localizadas en los tejidos infectados detectan los PAMPs del virus con sus TLR (y otros receptores de PAMPs), fagocitan el virus, y luego transforman los antígenos virales para que estos puedan ser presentados a los linfocitos T, por mediación de las moléculas del Complejo Principal de Histocompatibilidad I y II (MHC-I y MHC-II, de sus siglas en inglés) (de León, 2020). Como se muestra en la Figura 2B, las células dendríticas maduras, además, expresan diversas moléculas de co-estimulación y secretan citocinas, todo lo cual influye en la activación de los linfocitos T. Los linfocitos T auxiliadores CD4+ reconocen los antígenos virales presentados por MHC-II a través de su Receptor de Células T (TCR, de sus siglas en inglés). Esto lleva a que se activen, proliferen y se diferencien a un tipo de linfocito auxiliador, llamado Th1, que secreta IFN tipo II (IFNgamma). Los Th1 son muy relevantes en la respuesta antiviral, al estimular la actividad de macrófagos, los NK, los neutrófilos y los linfocitos B. Por su parte, los linfocitos T citotóxicos CD8+ reconocen, también a través de su TCR, a los antígenos virales presentados en MHC-I, lo que determina su activación como célula con capacidad citotóxica (de León, 2020).
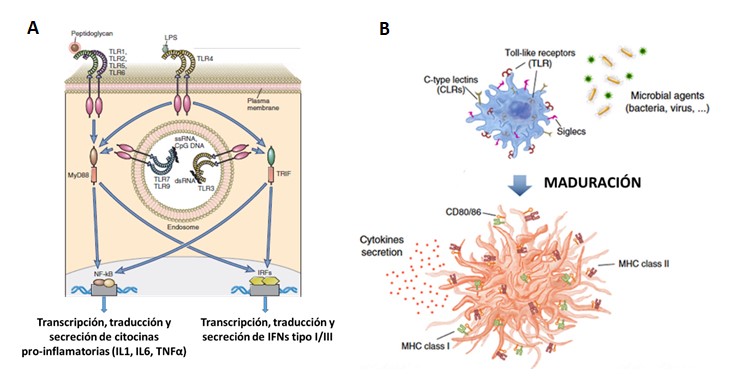
Figura 2. La señalización a través de los Receptores tipo Toll (TLRs) induce: (A) la transcripción, traducción y secreción de citocinas inflamatorias y de IFNs tipo III. Tomado y modificado de Abbas et al., 2017; (B) la maduración y migración de las células dendríticas desde los tejidos infectados a los órganos linfoides secundarios, lo cual es determinante para la presentación de antígenos virales en las moléculas MHC y la activación de los linfocitos T. Tomado y modificado de Crespo et al., 2013
La acción coordinada de todos estos mecanismos debe asegurar el control de la infección viral y la recuperación de la homeostasis en los tejidos afectados. Sin embargo, hay dos condiciones que pueden alterar la efectividad de la respuesta inmune: 1) los diversos mecanismos que implementan los virus para escapar de la vigilancia inmunológica; en el caso del SARS-CoV-2 se ha identificado la ocurrencia de linfopenia, especialmente de linfocitos T citotóxicos y NK, así como una reducción en la funcionalidad de las mismas (Zheng et al., 2020); 2) la inadecuada regulación de la magnitud y la duración de respuesta inmune, lo que produce un contexto inmunopatológico; esta condición se presenta en un porciento de los pacientes infectados con SARSCoV-2, los cuales desarrollan un estado inflamatorio sistémico consecuencia de la llamada ¨tormenta de citocinas¨, cuyo control es imprescindible para manejar los síntomas graves de la enfermedad y evitar un desenlace fatal en los pacientes (Abdin et al., 2020; Henderson et al., 2020)
II. Estrategias de inmunización contra SARS-CoV-2
Inmunizar a la población, fundamentalmente en edad pediátrica, para prevenir más de una veintena de infecciones es sin dudas el procediendo con mejor relación costo-beneficio que la salud pública ha implementado en la última centuria (OMSb, 2020). Diversas plataformas tecnológicas se pueden aplicar para asegurar la eficacia de la inmunoterapia activa contra el patógeno de interés, las cuales se han explorado, a
nivel preclínico y clínico, para promover inmunidad contra SARS-CoV-2 (van Riel y de Wit, 2020). En este sentido, un elemento muy significativo, es la inducción de una respuesta de memoria contra el patógeno mediada por los componentes de la respuesta adaptativa, o sea los linfocitos B (secretores de anticuerpos) y los linfocitos T. La respuesta de memoria asegura que, al ocurrir el contacto natural con el patógeno, el sistema inmune desarrolla una respuesta cuantitativa y cualitativamente superior que limita su infección. Para conseguir este efecto, los preparados vacunales incluyen antígenos altamente inmunogénicos (o sea que despiertan la respuesta inmune) proveniente de los patógenos y, además, otras moléculas con capacidad inmunomoduladora, como los adyuvantes (Mohan et al., 2013). Las estrategias de delivery, la formulación de la vacuna, las dosis y el esquema de vacunación son aspectos muy importantes para inducir una inmunidad protectora de larga duración.
En lo que se refiere al SARS-CoV-2, hasta el momento se encuentran en activo más de 140 proyectos de inmunoterapia activa en etapa preclínica, y más de 100 en alguna de las fases de investigación clínica (Figura 3). De estos últimos, 29 proyectos clínicos exploran la inmunización específica contra antígenos de SARS-CoV-2, liderados por instituciones de diversos países que colaboran entre sí, con la participación de empresas farmacéuticas (OMSc, 2020). Entre estos estudios se destacan los desarrollados por el Instituto Edward Jenner de la Universidad de Oxford, con el apoyo logístico y financiero de la compañía farmacéutica AstraZeneca, y el impulsado por la compañía biotecnológica Moderna, en los Estados Unidos. A continuación, se describen brevemente los resultados publicados respecto a estos dos candidatos vacunales, que se encuentran en la Fase III de investigación clínica
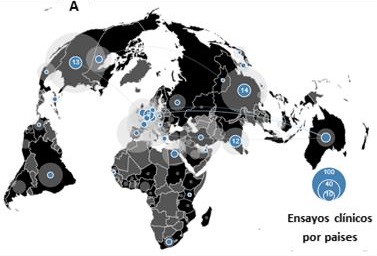
Figura 3. Ensayos clínicos basados en diversas plataformas de inmunoterapia activa para inmunizar contra antígenos de SARS-CoV2, o estimular la respuesta inmune inespecífica en pacientes con la COVID-19 (Total 104 ensayos). En todos los casos, las líneas azules representan los países que colaboran en la realización de los ensayos clínicos. Tomado del sitio web desarrollado por Boutron et al., 2020 (https://covid-nma.com/dataviz/#)
Preparado vacunal de Oxford/AztraZeneca
La prestigiosa revista The Lancet publicó recientemente los resultados de la aplicación de un candidato vacunal, cuyo diseño se basa en la expresión de la proteína S del SARS-CoV-2 en un adenovirus de chimpancé (Folegatti et al., 2020). La proteína S se ha escogido, para esta y otras propuestas vacunales, por su alta inmunogenicidad (Walls et al., 2020) y por su relevancia para la interacción del SARS-CoV-2 con la Enzima Convertidora de Angiotensina 2 (ACE2, de sus siglas en inglés), la cual es la vía de acceso del virus a las células (Quiroz et al., 2020). Este estudio clínico ha demostrado que la respuesta de anticuerpos contra la proteína S, que se induce en los voluntarios sanos vacunados, es equivalente a la detectada en el suero de pacientes convalecientes, tanto en su cantidad como en su capacidad neutralizante. No menos importante es la demostración de que en los individuos vacunados se detectó la presencia de linfocitos T específicos para esta proteína, secretores de IFNgamma. Todo lo anterior se logra sin provocar, en los voluntarios incluidos en el estudio, efectos secundarios tóxicos de consideración (Folegatti et al., 2020).
Preparado vacunal de Moderna
La plataforma vacunal utilizada por la empresa Moderna, cuyos resultados han sido publicados en la revista New England Journal of Medicine, se basa en la inmunización de voluntarios sanos con el ARN viral (Jackson et al., 2020). Este candidato vacunal, también resulta altamente inmunogénico. Además, es efectivo respecto a su capacidad de inducir anticuerpos que neutralizan la capacidad infectiva del virus, sin producir efectos tóxicos de consideración en los individuos vacunados.
III. Inmunoterapia pasiva en el manejo de la COVID-19
Diversas son las estrategias que se han ensayado para controlar la infectividad celular del SARS-CoV-2 y el efecto inmunopatogénico del mismo en pacientes con COVID-19, fundamentalmente: 1) los IFNs tipo I; 2) el bloqueo de las citocinas inflamatorias con moléculas antagonistas y anticuerpos monoclonales; 3) el uso del plasma de pacientes convalecientes. Este grupo de abordajes terapéuticos recibe el nombre de inmunoterapia pasiva, o sea que, a diferencia de las vacunas, no inducen memoria inmunológica en los pacientes. Otra variante, ensayada como alternativa para controlar la inflamación en estos pacientes, es el uso de fármacos anti-inflamatorios convencionales, como la dexametasona (RECOVERY collaborative group et al., 2020).
IFNs tipo I
La relevancia de los IFNs tipo I en el control de la replicación viral, y su deficiente producción en pacientes con la COVID-19, se mencionó anteriormente. Esto explica la racionalidad del uso de estas moléculas para tratar la COVID-19, especialmente en la fase temprana de la infección. Las experiencias con el uso de IFN tipo I-β, tanto in vitro (Mantloa et al., 2020) como en estudios clínicos (Fan-Ngai et al., 2020; Naghibi et al., 2020), sugiere el potencial beneficio de esta molécula en el control de la carga viral en pacientes con la COVID-19. El ensayo clínico Solidaridad, organizado por la OMS, y del que Perú forma parte, incluye un grupo de tratamiento que recibe la molécula IFN recombinante tipo I-β1a (OMSd, 2020). Adicionalmente, se ha propuesto considerar el uso de IFNs tipo III, pues a pesar de tener una menor capacidad para inhibir la replicación viral respecto a los IFNs tipo I, su potencial efecto pro-inflamatorio también es menor (Park e Iwasaki, 2020).
Bloqueo de citocinas inflamatorias
Considerando la relevancia de las citocinas pro-inflamatorias en la inmunopatogenia del SARS-CoV-2, y en su consecuencia para el curso grave de la COVID-19, el bloqueo de estas moléculas es una de las estrategias más atractivas en investigación clínica (Harrison, 2020). Como muestra la Figura 4A, más de 120 estudios clínicos están activos para evaluar la efectividad del uso de anticuerpos monoclonales (AcMs) específicos contra mediadores de la inflamación, algunos de ellos combinados con otras estrategias terapéuticas.
Citocinas inflamatorias como la IL6 y la IL1β se han identificado como biomarcadores pronósticos del curso clínico grave de la COVID-19 (Herold et al., 2020; Ziying Ong E et al., 2020). En consecuencia, el bloqueo de estas moléculas se ensaya con AcMs, como es el caso del tocilizumab (AcM humanizado específico contra el receptor de la IL6) (Guaraldi et al., 2020; Sciascia et al., 2020) y con la molécula antagonista de IL1β, Anakinra (Huet et al., 2020). Vale resaltar que estas moléculas terapéuticas no se han diseñado específicamente para el tratamiento de la COVID-19, sino que, como muchas otras, se han registrado previamente para otras patologías y actualmente se valora su eficacia frente al SARS-CoV-2. Otros AcMs en estudio, con potencial efecto anti-inflamatorio en el contexto de la COVID-19, son: AcM humano sekukimumab (anti-IL17); AcM humanizado ravalizumab (anti-C5); AcM humano emapalumab (anti-IFNgamma); AcM humanizado crizanlizumab (anti-P selectina) (Boutron et al., 2020). Un ejemplo interesante de la re-evaluación en la COVID-19 de AcMs previamente registrados, es el caso del AcM humanizado, anti-CD6, itolizumab (Saavedra et al., 2020). Este AcM, que inhibe una de las moléculas de co-estimulación de los linfocitos T, se ha registrado previamente para el tratamiento de enfermedades psoriasis severa y artritis reumatoide (Hernández et al., 2020).
Plasma de pacientes convalecientes
El uso del plasma colectado de pacientes recuperados de la COVID-19 es una alternativa muy interesante, que se explota actualmente para controlar la evolución de la enfermedad. Actualmente, un centenar de ensayos clínicos, dos de ellos en Perú, persigue demostrar la efectividad de este procedimiento (Figura 4B).
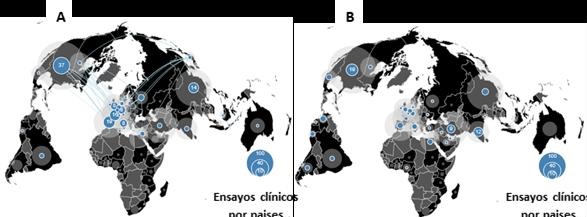
Figura 4. Ensayos clínicos basados en diversas estrategias de inmunoterapia pasiva aplicadas a pacientes con COVID-19. (A) Ensayos clínicos basados en el uso de anticuerpos monoclonales (Total 127 ensayos); (B) Ensayos clínicos basados en el uso de plasma de individuos convalecientes (Total 105 ensayos). En todos los casos, las líneas azules representan los países que colaboran en la realización de los ensayos clínicos. Tomado del sitio web desarrollado por Boutron et al., 2020 (https://covid-nma.com/dataviz/#)
Al respecto, la Administración de Drogas y Alimentos de Estados Unidos (FDA, de sus siglas en inglés), ha dictado una guía con sugerencias acerca de las características de los donantes y los aceptores en este tratamiento (FDA, 2020). Esta guía FDA sugiere que los pacientes en condición de gravedad sean quienes reciban este tratamiento (al menos durante la fase de investigación clínica), y que los donantes convalecientes tengan al menos dos semanas sin síntomas y un determinado título de anticuerpos en suero con capacidad de neutralizar el virus. Algunos resultados preliminares sugieren la potencial eficacia de esta inmunoterapia pasiva, con importantes mejoras en indicadores clínicos de los pacientes tratados en condición severa, incluyendo: el incremento de la saturación de oxígeno, la reducción de marcadores sistémicos de inflamación, y la recuperación de la linfopenia (Duan et al., 2020).
Una limitación de este procedimiento es que el mismo no permite valorar la ¨calidad¨ de los anticuerpos presentes en el suero convaleciente, ni la influencia de otras moléculas presentes en el suero sobre los pacientes aceptores. Siendo así, se ha ensayado una estrategia de inmunoterapia pasiva basada en el uso de AcMs específicos contra las proteínas virales, especialmente contra la proteína S por su relevancia en la capacidad infectiva del virus (Jahanshahlua y Rezaeic, 2020). Esta estrategia, sin embargo, es de un costo significativamente mayor (especialmente el proceso de generación y caracterización de los AcMs), y su tiempo de implementación, incluyendo la evaluación clínica, atenta contra la relación costo-beneficio en una situación de emergencia sanitaria.
IV. La respuesta inmune en el diagnóstico y evaluación clínica de la COVID-19
La determinación directa de la presencia del SARS-CoV-2 en las células del epitelio respiratorio con técnicas como la Reacción en Cadena de la Polimerasa en Tiempo Real (RT-PCR, de sus siglas en inglés), es el diagnóstico molecular aceptado para la COVID-19. Sin embargo, la detección de anticuerpos específicos contra el virus en inmunoensayos se ha posicionado como un estudio simple, rápido y con niveles aceptables de especificidad y sensibilidad para identificar pacientes con COVID-19. En Perú, por ejemplo, alrededor del 60% de los pacientes reportados diariamente por el Ministerio de Salud corresponde a pruebas serológicas donde se han detectado estos anticuerpos (MINSAa, 2020).
Si bien los pacientes tienen cinéticas variables, en cuanto al periodo de detección del virus y la aparición en el suero de los anticuerpos antivirales (IgM e IgG), en general se han establecido plazos de tiempo para la efectividad de uno u otro método diagnóstico de la COVID-19 (Figura 5). Considerando que la presencia de anticuerpos en el suero, especialmente los de tipo IgG, puede extenderse hasta varios meses después de eliminada la presencia del virus en el organismo, muchos pacientes pueden ser diagnosticados tardíamente, especialmente aquellos con un curso asintomático de la enfermedad.
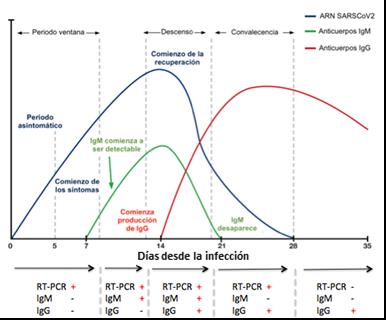
Figura 5. Etapas generales del curso de la COVID-19 donde se indican los periodos en que resulta efectiva la aplicación de la prueba de diagnóstico molecular (RT-PCR) o serológica (IgM/IgG). Los plazos de tiempo mostrados en esta imagen son solo referenciales. Tomado y modificado del sitio web del Laboratorio HC Marbella https://www.hcmarbella.com/es/tecnicas-para-un-diagnostico-de-certero-y-precoz-de-covid-19/
Un aspecto en debate ha sido precisamente la duración de los anticuerpos anti-SARS-CoV-2 en el suero de los pacientes convalecientes. Evidencias recientes indican que, alrededor de dos meses después del alta de la enfermedad, el 40 % de los pacientes asintomáticos y el 13 % de los pacientes sintomáticos no presentan cantidades detectables de anticuerpos IgG contra el virus en el suero (Long et al., 2020). Esta situación limita la propuesta de un ¨pasaporte inmunológico¨, basado en la presencia de anticuerpos contra-SARS-CoV-2 en sangre, como evidencia de inmunidad contra el virus. Otros escenarios, muchos más complejos de extender por su complejidad tecnológica, sugieren que la respuesta de memoria mediada por linfocitos T tiene una relevancia significativamente mayor y podría por tanto ser un adecuado referente de inmunidad antiviral (Sekine, et al., 2020; Le Bert et al., 2020).
Además de los marcadores moleculares asociados al diagnóstico de la COVID-19, se han identificado otros marcadores de evolución clínica con valor pronóstico, como los niveles de ferritina (Gómez-Pastora et al., 2020) y del dímero-D (Zhang et al., 2020). Sin embargo, aún se mantiene muy activa la búsqueda de biomarcadores inmunológicos que permitan el pronóstico temprano del curso de la enfermedad y predecir la efectividad de las estrategias terapéuticas. Para este propósito son muy relevantes las investigaciones donde se relaciona la evolución del perfil inmunológico de los pacientes con el curso clínico de la COVID-19 (Laing et al., 2020; Messner et al., 2020; Shen et al., 2020; Lucas, et al., 2020)
V. Retos y fortalezas de la investigación clínica en el contexto de la pandemia por SARS-CoV-2
Como se mencionó anteriormente, alrededor del mundo se están desarrollando numerosos ensayos clínicos relacionados con el control o el manejo de la COVID-19. Hasta el 8 de agosto de 2020 se registraron, en la Plataforma de Registros Internacionales de Ensayos Clínicos de la OMS, un total de 1554 estudios (Figura 6).
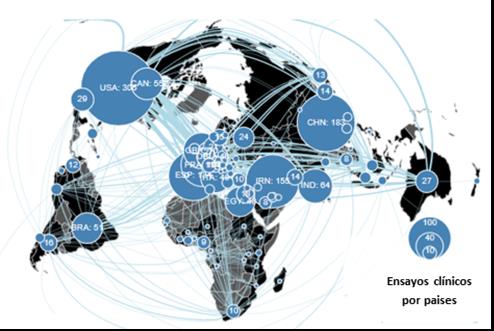
Figura 6. Ensayos clínicos dedicados a la investigación sobre terapias para la prevención, el tratamiento y el pos-tratamiento de la COVID-19, registrados en la Plataforma de Registros Internacionales de Ensayos Clínicos (IC-TRP) de la OMS (Total 1554). Las líneas azules representan los países que colaboran en la realización de los ensayos clínicos. Tomado del sitio web desarrollado por Boutron et al., 2020 (https://covid-nma.com/dataviz/#)
Sin embargo, la pandemia ha marcado grandes retos y fortalezas para la
investigación clínica, entre los que destacan:
Enfrentar una enfermedad desconocida
Los datos anteriores permiten comprender la difícil tarea de desarrollar un tratamiento o una vacuna efectiva, para esta nueva enfermedad, por las lagunas sobre los aspectos virológicos, epidemiológicos y clínicos de la misma (Reina, 2020). El 30 de enero, debido a la situación epidemiológica existente, la OMS declaró este brote una Emergencia de Salud Pública de Importancia Internacional (ESPII). Con el objetivo de impulsar la investigación en torno a esta infección, y movilizar recursos humanos y financieros con este fin, se convocó en febrero de este año el Foro Mundial de Investigación e Innovación y se re-activó la Coalición Blueprint, creado por la OMS en el 2016 para fijar las pautas de investigación y desarrollo de productos durante las epidemias. Esto permitió evaluar los conocimientos sobre esta nueva enfermedad, y acelerar el desarrollo de medios diagnósticos, tratamientos y vacunas. En marzo de 2020 se estableció una hoja de ruta para la investigación mundial contra esta nueva cepa de coronavirus (OMSe, 2020).
Tiempo
Habitualmente el desarrollo y la investigación clínica de un nuevo medicamento toma entre 10 y 15 años (Figura 7). Sin embargo, el número creciente de casos y fallecidos a nivel mundial por la COVID-19 ha impuesto la necesidad de reducir los plazos de tiempo de cada una de las fases de investigación clínica. La aceleración de la investigación puede conducir a errores, incluyendo la interpretación errónea de la realidad o sesgo. Este constituye el mayor enemigo de la investigación clínica, pues da lugar a falsos resultados que pueden llevar al registro de medicamentos poco efectivos, o que provoquen en las personas que los consuman más riesgos que beneficios. El sesgo en la investigación clínica se debe a la presencia de uno o más de los siguientes aspectos: la data incorrecta, la data falsa, los pacientes mal incluidos, los eventos no reportados, los eventos reportados a destiempo y la influencia consciente o subconsciente del investigador
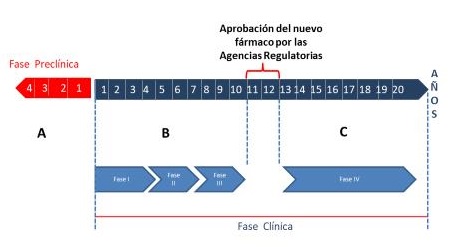
Figura 7. Línea de tiempo del desarrollo de un nuevo fármaco. (A) Tiempo estimado de desarrollo de la fase preclínica; B) Tiempo estimado del desarrollo de las fases I, II y III en los ensayos clínicos; C) El nuevo fármaco puede ser comercializado; durante esta etapa se desarrollan los estudios fase IV
Además, se deben considerar los retos que pueden conducir a errores o gastos innecesarios debido a la combinación o superposición de las fases de investigación clínica, para acortar su duración (Asociación Española de Vacunología, 2020; Lurie et al., 2020), incluyendo: 1) no contar con el tiempo adecuado para analizar los resultados obtenidos en cada fase clínica; 2) enrolar un mayor número de personas en cada fase de los que se enrolan habitualmente; por ejemplo, el número máximo de enrolados, habitualmente desde la fase I hasta la fase III no supera los 5400 individuos, sin embargo, en los estudios del candidato vacunal que desarrolla la Universidad de Oxford se estima enrolar más de 10 200 participantes durante la fase 2/3, lo que puede provocar que mayor cantidad de personas se afecten, de producirse un evento adverso (ClinicalTrials.gov, 2020); 3) la construcción de plantas de producción para una posible vacuna que no llegue a ser aprobada por las Agencias Regulatorias; 4) garantizar, una vez aprobada la vacuna, que los métodos de manufactura y de control sean los adecuados para asegurar la identidad, calidad y pureza de la misma, a pesar del gran volumen de producción en un corto período de tiempo.
Recursos financieros suficientes
A pesar de la crisis financiera que atraviesa el planeta, debido a la pandemia se hace imprescindible un financiamiento aproximado de USD31 300 millones durante los próximos 12 meses para financiar las investigaciones, el desarrollo de pruebas diagnósticas, los tratamientos, las vacunas, capacitar al personal y crear las herramientas imprescindibles que harán posible la conexión y el aseguramiento de los sistemas de salud a nivel mundial. De este total, se han recaudado poco más del 10 %, por lo que aún existe un déficit importante de recursos para este fin. Un dato a destacar, es que se necesitan USD18 100 millones para el desarrollo de vacunas, recursos que asegurarían 1000 millones de dosis destinadas a distribuirse en los países de bajos y medianos recursos antes de finalizar el 2021 (OMSg, 2020).
Desinformación
En muchas ocasiones las redes sociales y la prensa se hacen eco de información falsa o que no está científicamente comprobada. A nivel poblacional, estos rumores han llegado a poner en riesgo la salud y hasta la vida de algunas personas, que por temor al contagio o a desarrollar una forma severa de la COVID-19, han consumido medicamentos que no tienen los controles de calidad necesarios o no están aprobados para el consumo humano. Tal es el caso de la Ivermectina para uso veterinario o el Dióxido de Cloro (MINSAb, 2020). A nivel de información profesional, el considerar como resultados validados los datos aparecidos en revistas de divulgación científicas (alguno de los cuales no han sido corroborados), ha conducido a tomar decisiones equivocadas y crear pautas erradas en el tratamiento de la COVID-19.
Fortalezas que facilitan el rápido desarrollo de la investigación clínica
Para sortear los retos que impone el agilizar la investigación y desarrollo de nuevos tratamientos y pruebas diagnósticas, la OMS no solamente ha reactivado la Coalición Blueprint, sino que creó y organizó el ensayo clínico Solidaridad, para evaluar a escala internacional, y con la consecuente diversidad genética y cultural, el efecto de cuatro fármacos (Remdisivir, Interferón β-1a, Lopinavir/Ritonavir y Cloroquina e Hidroxicloroquina) sobre la reducción de la progresión y/o mortalidad por SARS-CoV-2 en pacientes adultos (OMSd, 2020) Como se mencionó anteriormente, Perú forma parte de este estudio. Además, la OMS ha establecido alianzas estratégicas con distintas organizaciones como CEPI, la Alianza Global para Vacunas e Inmunización (GAVI) la cual facilita el acceso a la inmunización en los países pobres, la Fundación de Naciones Unidas, y otras organizaciones y líderes mundiales. Esta cooperación ha posibilitado la implementación del método ¨velocidad de pandemia¨, en la que la generación de plataformas de investigación y desarrollo de vacunas ocurren en plazos muy cortos. Este método consiste en la aceleración y/o combinación de las diferentes etapas de la investigación preclínica o clínica, pudiendo alcanzarse prematuramente la fase III del ensayo clínico, donde son enrolados un gran número de personas. Conjuntamente con la investigación y el desarrollo de las vacunas, se inicia la construcción de las fábricas de producción de la misma, con el objetivo de que una vez culminado el estudio y aprobada esta, pueda asegurarse una temprana producción a gran escala (Figura 8).
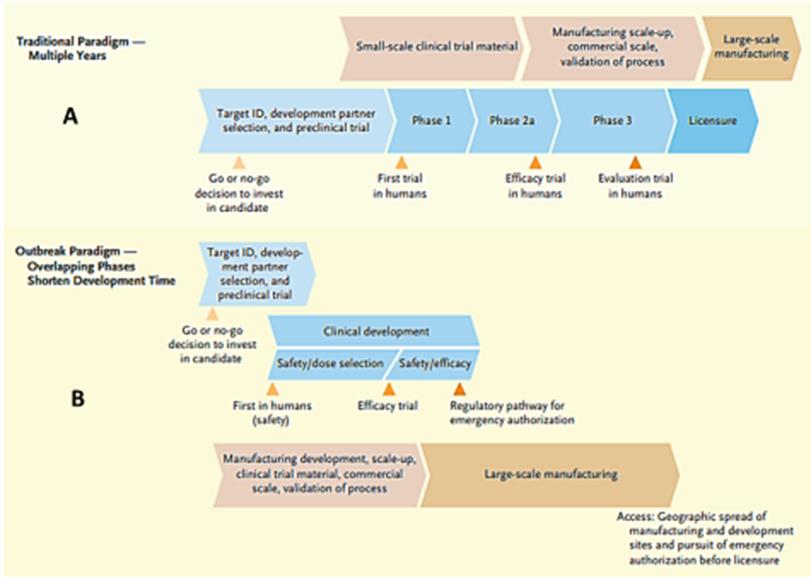
Figura 8. Diferencia entre (A) el desarrollo tradicional de vacunas y (B) el desarrollo de vacunas usando el método “velocidad de pandemia”. Tomado y modificado de Lurie et al., 2020
El copatrocinio, por el Director General de la OMS, el Presidente de
Francia, la Presidenta de la Comisión Europea, y la Fundación Bill y Melinda
Gates, ha permitido llevar a cabo el proyecto Acelerador de Acceso a
Herramientas COVID-19 (ACT, de sus siglas en inglés), el cual tiene como
objetivo lograr los siguientes beneficios: en el corto plazo, salvar vidas y
reducir las manifestaciones más graves de la COVID-19 y así proteger los
sistemas de salud y restablecer la plena actividad social y económica a nivel
mundial; en el mediano plazo, facilitar un
alto nivel de control de la COVID-19.
Para lograr estos beneficios el proyecto ACT se basa en estos cuatro
pilares: 1) Diagnóstico; 2) Tratamiento; 3) Inmunización (lograr 2000 millones
de dosis de vacunas seguras y eficaces para finales de 2021, de las cuales 1000
millones están destinadas a países de medianos y bajos ingresos; 4) Conexión de
los sistemas de salud (OMSg, 2020). Con el fin de recaudar los fondos
necesarios para llevar a cabo estos proyectos, la OMS junto a la Fundación de
Naciones Unidas, creó el Fondo de Respuesta Solidaria a la COVID-19 (OMSh,
2020).
Esta red de información se ha extendido también al público en general con el objetivo de disminuir y frenar los rumores y la desinformación sobre la COVID-19, generada tanto por las redes sociales, como por artículos sensacionalistas de la prensa (ONU, 2020).
CONCLUSIONES
La emergencia de salud que ha impuesto la morbi-mortalidad asociada al SARS-CoV-2, ha movilizado los recursos humanos y financieros dedicados a la investigación preclínica y clínica, para registrar en el menor tiempo posible, estrategias de inmunoterapia efectivas para inmunizar y/o manejar las consecuencias de la infección. En consecuencia, cientos de ensayos clínicos en diferentes fases de desarrollo se enfrentan, no solo a las presiones y regulaciones propias de este tipo de investigación, sino además (posiblemente como nunca antes) a presiones de índole política, financiera, económica y social que exigen se logre un producto efectivo, en el menor tiempo posible, y cuya distribución sea masiva. La coordinación entre los organismos internacionales, la academia y las empresas farmacéuticas es, como nunca antes, determinante para revertir esta situación cuyo impacto socio-económico ha cambiado (en algunos aspectos, tal vez para siempre) la vida de nuestra especie.
REFERENCIAS BIBLIOGRÁFICAS
- Abbas, A. K. Lichtman, A. H. y Pillai, S. (2017). Cellular and Molecular Immunolgy (9na ed). Elsevier.
- Abdin, S. M., Elgendya, S. M., Alyammahia, S. K., Alhamada, D.W. y Omara, H. A. (2020). Tackling the cytokine storm in COVID-19, challenges and hopes. Life Sciences, 257:118054
- Asociación Española de Vacunología. [Consultado Agosto 2020]. Disponible en: https://www.vacunas.org/cuanto-tiempo-lleva-fabricar-una-vacuna-o-como-conseguir-lo-imposible/¿Cuánto tiempo lleva fabricar una vacuna o cómo conseguir lo imposible?
- Blanco-Melo, D., Nilsson-Payant, B. E., Liu, W. C., Uhl, S., Hoagland, D., Moller, R. et al. (2020). Imbalanced host response to SARS-CoV-2 drives development of COVID-19. Cell, 181(5):1036-45.
- Boutron, I., Chaimani, A., Devane, D., Meerpohl, J. J, Tovey, D., Hróbjartsson, A., et al. (2020). Living mapping and living systematic review of Covid-19 studies. Disponible en: https://covid-nma.com/
- Clinicaltrials.gov. [Consultado Agosto 2020]. Disponible en: https://clinicaltrials.gov/ct2/show/NCT04400838
- Crespo, H. J., Lau, J.T.Y. y Videira, P. A. (2013). Dendritic cells: a spot on sialic acid. Frontiers in Immunology, 4(491):1.
- de León, J., Pareja, A., Aguilar P, Enriquez Y, Quiroz C, Valencia E (2020). SARS-CoV-2 y sistema inmune: una batalla de titanes. Horizonte Médico, 20 (2): e1209.
- Dinarello CA (2018). Overview of the IL-1 family in innate inflammation and acquired immunity. Immunol Rev, 281(1): 8–27.
- Duana K, Liuc B, Lid C, Zhange H, Yuf T, Qu J, et al. (2020). Effectiveness of convalescent plasma therapy in severe COVID-19 patients. PNAS, 117(17):9490–9496.
- Esposito E, Cuzzocrea S (2009). TNF-alpha as a therapeutic target in inflammatory diseases, ischemia-reperfusion injury and trauma. Curr Med Chem, 16(24):3152-67.
- Fan-Ngai I, Lung K, Yuk-Keung E, Liu R, Wai-Hin Tom, Chu MY, et al. (2020). Triple combination of interferon beta-1b, lopinavir–ritonavir, and ribavirin in the treatment of patients admitted to hospital with COVID-19: an open-label, randomised, phase 2 trial. The Lancet, 395 (10238):1695-1704.
- FDA. Recommendations for investigational COVID-19 convalescent plasma. [Internet]. [Consultado Agosto 2020] Disponible en: https://www.fda.gov/vaccines-blood-biologics/investigational-new-drug-ind-or-device-exemption-ide-process-cber/revised-information-investigational-covid-19-convalescent-plasma
- Folegatti PM, Ewer KJ, Aley PK, Angus B, Becker S, Belij-Rammerstorfer S, et al. (2020). Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet, 396 (10249):467-478.
- GenBank. Severe acute respiratory syndrome coronavirus 2 isolate Wuhan-Hu-1, complete genome. Disponible en: https://www.ncbi.nlm.nih.gov/nuccore/MN908947.3
- Gómez-Pastora J, Weigand M, Kim J, Wu X, Strayer J, Palmer AF, et al. (2020). Hyperferritinemia in critically ill COVID-19 patients–Is ferritin the product of inflammation or a pathogenic mediator? Clin Chim Acta, 509:249-251.
- Guaraldi G, Meschiari M, Cozzi-Lepri A, Milic J, Tonelli R, Menozzi M, et al. (2020). Tocilizumab in patients with severe COVID-19: a retrospective cohort study. 2(8): E474-E484.
- Hadjadj J, Yatim N, Barnabei L, Corneau A, Boussier J, Smith N, et al. (2020). Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science, 369(6504):718-724.
- Harrison C (2020). Focus shifts to antibody cocktails for COVID-19 cytokine storm. Nature Biotechnology, 38:905–916.
- Henderson LA, Canna SW, Schulert GS, Volpi S, Lee PY, Kernan KF, et al., (2020). On the alert for cytokine storm: immunopathology in COVID-19. Arthritis Rheumatology, 72(7):1059-1063.
- Hernández P, Moreno E, Aira LE, Rodríguez PC (2016). Therapeutic Targeting of CD6 in Autoimmune Diseases: A Review of Cuban Clinical Studies with the Antibodies IOR-T1 and Itolizumab. Curr Drug Targets. 2016;17(6):666-77.
- Herold T, Jurinovic V, Arnreich C, Hellmuth JC, Bergwelt-Baildon M, Klein M, Weinberger T (2020). Elevated levels of IL-6 and CRP predict the need for mechanical ventilation in COVID-19. J Allergy Clin Immunol, 146(1):128–136.
- Huet T, Beaussier H, Voisin O, Jouveshomme S, Dauriat G, Lazareth I, et al. (2020). Anakinra for severe forms of COVID-19: a cohort study. Lancet Rheumatology, 2:e393-400.
- Hunter CA & Jones SA (2015). IL-6 as a keystone cytokine in health and disease. Nature Immunology, 16:448–457.
- Ivashkiv LB, Donlin LT (2014). Regulation of type I interferon responses. Nat Rev Immunol, 14(1):36-49.
- Jackson LA, Anderson EJ, Rouphael NG, Roberts PC, Makhene M, Coler RN, et al. (2020). An mRNA vaccine against SARS-CoV-2-preliminary report. N Engl J Med. DOI: 10.1056/NEJMoa2022483.
- Jahanshahlua L, and Rezaeic N (2020). Monoclonal antibody as a potential anti-COVID-19. Biomed Pharmacother. 2020 Sep; 129: 110337.
- Laboratorio HC Marbella. [Consultado Agosto 2020] Disponible en https://www.hcmarbella.com/es/tecnicas-para-un-diagnostico-de-certero-y-precoz-de-covid-19/
- Laing AG, Lorenc A, del Molino I, Das A, Fish M, Monin L, Muñoz-Ruiz M, et al., (2020). A dynamic COVID-19 immune signature includes associations with poor prognosis. Nat Med. DOI: 10.1038/s41591-020-1038-6
- Le Bert N, Tan AT, Kunasegaran K, Tham CYL, Hafezi M, Chia M, et al. (2020). SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature, 584(7821):457-462.
- Li G, Fan Y, Lai Y, Han T, Li Z, Zhou P, et al. (2020). Coronavirus infections and immune responses. Journal of Medical Virology, 92(4):424-432.
- Long QX, Tang XJ, Shi QL, Li Q, Deng HJ, Yuan J, et al. (2020). Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nature Medicine, 26(8):1200-1204.
- Lucas C, Wong P, Klein J, Castro TBR, Silva J, Sundaram m, et al. (2020). Longitudinal analyses reveal immunological misfiring in severe COVID-19. Nature, 584(7821):463-469.
- Lurie N, Saville M, Hatchett R, Halton J (2020). Developing Covid-19 vaccines at pandemic speed. N Engl J Med, 382:1969-1973.
- Mantloa E, Bukreyevaa N, Maruyamaa J, Paesslera S, Huang C (2020). Antiviral activities of type I interferons to SARS-CoV-2 infection. Antiviral Research, 179:104811.
- Messner CB, Demichev V, Wendisch D, Michalick L, White M, Freiwald A, et al. (2020). Ultra-High-Throughput clinical proteomics reveals classifiers of COVID-19 Infection. Cell Systems, 11:11–24.
- MINSAa. Sala situacional COVID-19. [Consultado Agosto 2020] Disponible en: https://covid19.minsa.gob.pe/sala_situacional.asp
- MINSAb. [Consultado Agosto 2020]. MINSA alerta sobre uso indebido de Ivermectina para animales en tratamiento de COVID-19. Disponible en: https://www.gob.pe/institucion/minsa/noticias/186543-minsa-alerta-sobre-uso-indebido-de-ivermectina-para-animales-en-tratamiento-de-covid-19
- Mohan T, Verma P, Rao DN (2013). Novel adjuvants & delivery vehicles for vaccines development: a road ahead. Indian J Med Res, 138(5):779–795.
- Naciones Unidas. [Consultado Agosto 2020]. Disponible en: https://twitter.com/UNGeneva/status/1217146107957932032
- Naghibi SS, Golmohammadi M, Pourhoseingholi MA, Shokouhi S, Darazam IA (2020). Effectiveness of Interferon Beta 1a, compared to Interferon Beta 1b and the usual therapeutic regimen to treat adults with moderate to severe COVID-19: structured summary of a study protocol for a randomized controlled trial. Trials, 21(1):473.
- OMSa, WHO Coronavirus Disease (COVID-19) dashboard. [Consultado Agosto 2020] Disponible en: https://covid19.who.int/
- OMSb, Bulletin of the World Health Organization. Vaccination greatly reduces disease, disability, death and inequity worldwide. [Consultado Agosto 2020] Disponible en: https://www.who.int/bulletin/volumes/86/2/07-040089/en/
- OMSc. Draft landscape of COVID-19 candidate vaccines. [Consultado Agosto 2020] Disponible en: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines.
- OMSd. Ensayo clínico “Solidaridad” sobre tratamientos contra la COVID-19. [Consultado Agosto 2020] Disponible en: https://www.who.int/es/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-clinical-trial-for-covid-19-treatments.
- OMSe. Cronología de la respuesta de la OMS a la COVID-19 [Consultado Agosto 2020]. Disponible en: https://www.who.int/es/news-room/detail/29-06-2020-covidtimeline.
- OMSf. Preparación y respuesta ante emergencias. Nuevo coronavirus- Japón (procedente de China). [Consultado Agosto 2020]. Disponible en: https://www.who.int/csr/don/16-january-2020-novel-coronavirus-japan-ex-china/es/
- OMSg. Novedades sobre el acelerador del acceso a las herramientas contra la COVID-19. [Consultado Agosto 2020]. Disponible en: https://www.who.int/es/news-room/detail/26-06-2020-act-accelerator-update
- OMSh. Fondo de Respuesta Solidaria a la COVID-19 de la OMS. [Consultado Agosto 2020]. Disponible en: https://covid19responsefund.org/es/
- OMSi. Investigación global sobre la enfermedad por coronavirus (COVID-19). [Consultado Agosto 2020]. Disponible en: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov
- ONU. Verified. [Consultado Agosto 2020]. Disponible en: https://shareverified.com/en
- Park A, Iwasaki A (2020). Type I and Type III Interferons-induction, signaling, evasion, and application to combat COVID-19. Cell Host & Microbe, 27(6):870-878.
- Paules CI, Marston HD, Fauci AS (2020). Coronavirus infections-more than just the common cold. JAMA, 323(8):707-708.
- ProMED International Society for Infectious Disease. Neumonía no diagnosticada-China (Hubei): Solicitud de información. [Consultado Agosto 2020]. Disponible en: https://promedmail.org/promed-post/?id=6864153%20#COVID19
- Prompetchara E, Ketloy C, Palaga T (2020). Immune responses in COVID-19 and potential vaccines: lessons learned from SARS and MERS epidemic. Asian Pac. J. Allergy Immunol, 38(1):1-9.
- Quiroz CG, Pareja A, Valencia E, Pastora Y, de León J, Aguilar P (2020). Un nuevo coronavirus, una nueva enfermedad: COVID-19. Horizonte Médico, 20 (2): e1208
- RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, et al. (2020). Dexamethasone in hospitalized patients with Covid-19 - preliminary report. N Engl J Med. DOI: 10.1056/NEJMoa2021436.
- Reina J (2020). The SARS-CoV-2, a new pandemic zoonosis that threatens the world. Vacunas, 21 (1):17-22.
- Saavedra D, Añé-Kourí AL, Sánchez N, Filgueira LM, Betancourt J, Herrera C, et al. (2020). An Anti-CD6 monoclonal antibody (itolizumab) reduces circulating IL-6 in severe COVID-19 elderly patients. Immunity & Ageing. DOI:10.21203/rs.3.rs-32335/v1
- Sciascia S, Aprà F, Baffa A, Baldovino S, Boaro D, Boero R, et al. (2020). Pilot prospective open, single-arm multicenter study on off-label use of tocilizumab in patients with severe COVID-19. Clinical and Experimental Rheumatology 2020; 38: 529-532.
- Sekine T, Perez-Potti P, Rivera-Ballesteros O, Strålin K, Gorin JB, Olsson A, et al. (2020). Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19. Cell, DOI: https://doi.org/10.1016/j.cell.2020.08.017
- Shen B, Yi X, Sun Y, Bi X, Du J, Zhang C, et al. (2020). Proteomic and metabolomic characterization of COVID-19 patient sera. Cell, 182:59-72.
- Tesini BL. Coronavirus y síndromes respiratorios agudos (COVID-19, MERS, SARS) Manual MSD version para profesionales. [Consultado Agosto 2020] Disponible: https://www.msdmanuals.com/es/professional/enfermedades-infecciosas/virus-respiratorios/coronavirus-y-s%C3%ADndromes-respiratorios-agudos-covid-19-mers-y-sars
- Tyrrell D.A.J., Bynoe M.L. (1965). Cultivation of a novel type of common-cold virus in organ cultures. Br Med J, 1(5448):1467-1470.
- Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. (2020). Immunology of COVID-19: current state of the science. Immunity, 52:910-941.
- van Riel D & de Wit E (2020). Next-generation vaccine platforms for COVID-19. Nature Materials, 19:810–812.
- Walls AC, Park Y, Tortorici MA, Wall A, McGuire AT, Veesler D (2020). Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell, 181(2):281-292.
- Wraith DC (2017). The future of immunotherapy: a 20-year perspective image. Frontiers in Immunology, 8 (1668):1-6.
- Yajing F, Cheng Y, Wu Y (2020). Understanding SARS-CoV-2-mediated inflammatory responses: from mechanisms to potential therapeutic tools. Virologica Sinica, 35(3): 266-271.
- Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z, et al. (2020). D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19. J Thromb Haemost, 18(6):1324-1329.
- Zheng M, Gao Y, Wang G, Song G, Liu S, Sun D, Xu Y, Tian Z (2020). Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cellular and Molecular Immunology, 17:533-535.
- Ziying Ong E, Fu Zi Chan Y, Ying Leong W, Ying Lee NM, Kalimuddin S, Haja Mohideen SM, et al. (2020). A dynamic immune response shapes COVID-19 progression. Cell Host & Microbe 27(6):879-882.