Esta obra está bajo licencia internacional Creative Commons Reconocimiento 4.0
Recibido: 20/07/2020 Revisado: 25/07/2020 Aceptado: 01/08/2020 Publicado: 25/10/2020
RESUMEN
En diciembre de 2019 un nuevo virus apareció en Wuhan (China), el SARS-CoV-2, origen de la enfermedad denominada COVID19 que ha causado la pandemia que asola el planeta. A nivel mundial, la comunidad científica está dedicando todos sus esfuerzos para entender el virus, la enfermedad y para encontrar soluciones que saquen al mundo de esta pesadilla. En el presente artículo se revisan los datos de la evolución de la enfermedad, se describen los procesos biológicos que causan la mayoría de las muertes y se comentan los tratamientos utilizados para mitigar la enfermedad. Además, y visto que se trata de una enfermedad vírica, se describen el estado de las únicas soluciones posibles, que son el descubrimiento de un potencial fármaco, el desarrollo de una vacuna, así como la obtención de la inmunidad de grupo de una manera natural. Asimismo, exponemos un simple modelo matemático del crecimiento y decaimiento de los contagiados por la enfermedad. Este documento se escribe cuando todavía el número de infectados y de fallecimientos a nivel mundial todavía está en una fase de crecimiento, por ello este documento será parcial y solo se recogerán datos publicados hasta la fecha de redacción de este artículo (20/07/2020). Es posible que en un futuro próximo se produzcan avances en la investigación de esta causa y ciertas informaciones aquí mencionadas puedan quedar obsoletas, no obstante, este texto permitirá al lector crearse una leve imagen de la situación en julio de 2020.
Palabras clave: COVID-19, estrategias, fármacos, inmunidad, diagnóstico, vacunas.
ABSTRACT
In December 2019, a new virus appeared in Wuhan (China), SARS-CoV-2, the origin of the disease called COVID19 that has currently caused a pandemic that devastates the planet. Globally, the scientific community is dedicating all its efforts to understand the virus, the disease and to find solutions that will lead the world out of this nightmare. This article reviews the data on the evolution of the disease, describes the biological processes that cause the major part of the deaths, and discusses the treatments used to mitigate the disease. In addition, and taking into account that it is a viral disease, the status of the only possible solutions are described; which are the discovery of a potential drug, the development of a vaccine, and the achievement herd immunity. Likewise, we present a simple mathematical model of the growth and decay of the number of cases. This document is written when the number of cases and deaths worldwide are still in a growth phase, therefore this document will be partial and only data published up to the date of writing this article will be collected (07/20/2020). It is possible that in the near future there will be new research that may make some of the information mentioned here obsolete, however, this text will allow the reader to create a slight image of the situation in July 2020.
Keyword: COVID-19, strategies, drugs, immunity, diagnosis, vaccines.
INTRODUCCIÓNMás allá del impacto sobre la vida de millones de personas en todo el mundo, la pandemia del nuevo coronavirus también ha asestado un duro golpe sobre la evolución de la economía a nivel global. En abril de 2020 a más de la mitad de la población mundial, es decir 3.900 millones de personas, se les ha ordenado o se les ha solicitado medidas de confinamiento para evitar la difusión del virus (https://www.euronews.com/2020/04/02/coronavirus-in-europe-spain-s-death-toll-hits-10-000-after-record-950-new-deaths-in-24-hou). Por primera vez en la historia, el mundo se ha parado. El gráfico de la Figura 1 ilustra el profundo impacto del virus en los mercados y negocios de, prácticamente, todo el mundo, reflejando caídas de las bolsas más importantes de más del 30 %. Según la Organización para la Cooperación y el Desarrollo Económicos (OCDE) el crecimiento económico del mundo se reducirá en el 2020 un 50 %.
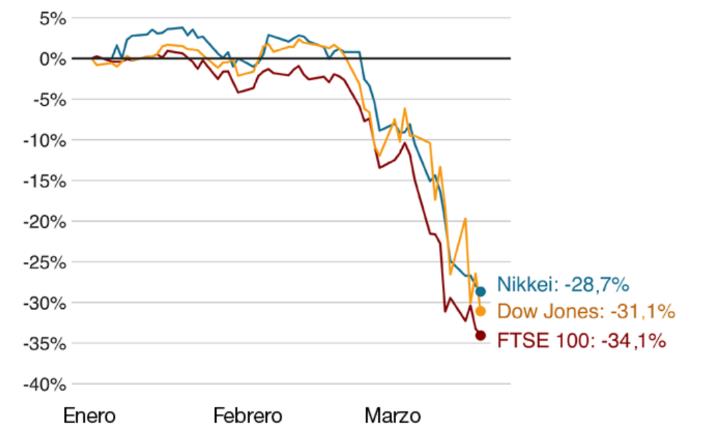
Figura 1. Evolución de distintas bolsas durante los meses de enero, febrero y marzo (hasta el día 19) cuando se inició la enfermedad (https://www.bloomberg.com).
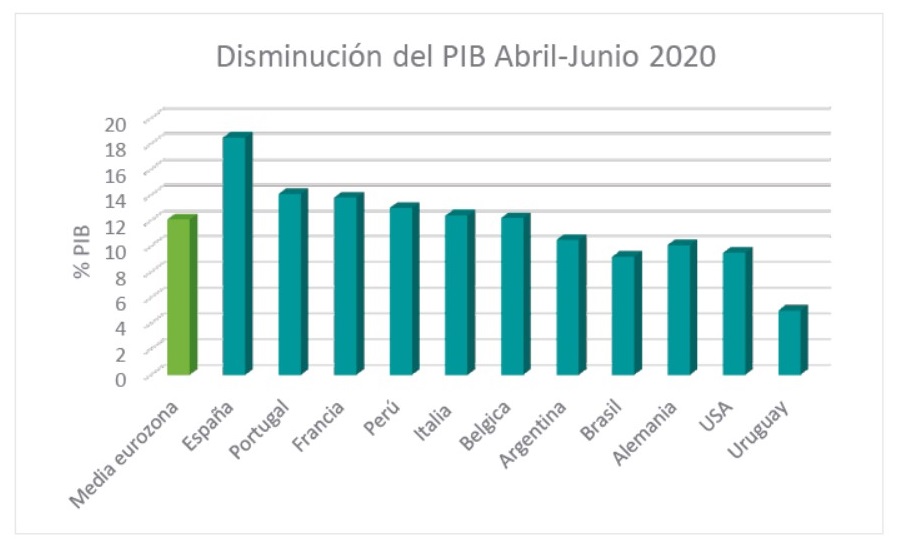
Figura 2. Caídas del PIB en distintos países de Europa y América
En el presente artículo se hará solo hincapié en la parte sanitaria, pero sin duda estamos ante una encrucijada. El problema del COVID-19 hay que considerarlo de una manera holística, donde la parte científica es muy crucial para solucionar el problema, pero tiene que venir acompañada por otras soluciones sociales, económicas y por supuesto políticas.
En la figura 3 se observa la evolución todavía creciente del número de casos positivos y de muertes diarias hasta en 20/072020.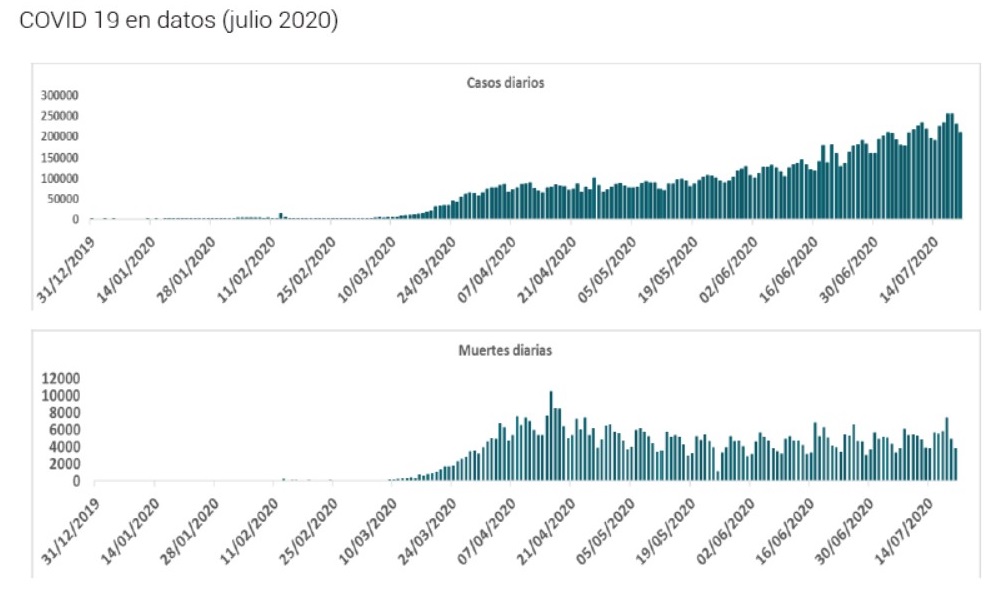
Figura 3. Número oficial de casos confirmados y fallecidos de COVID19 en el mundo desde el inicio de la pandemia. Datos tomados de la página de la OMS
El COVID19 presenta un nivel de mortalidad mucho mayor en edades superiores a los 70 años y una escasa gravedad para la gente joven, como se ve en la figura 4.
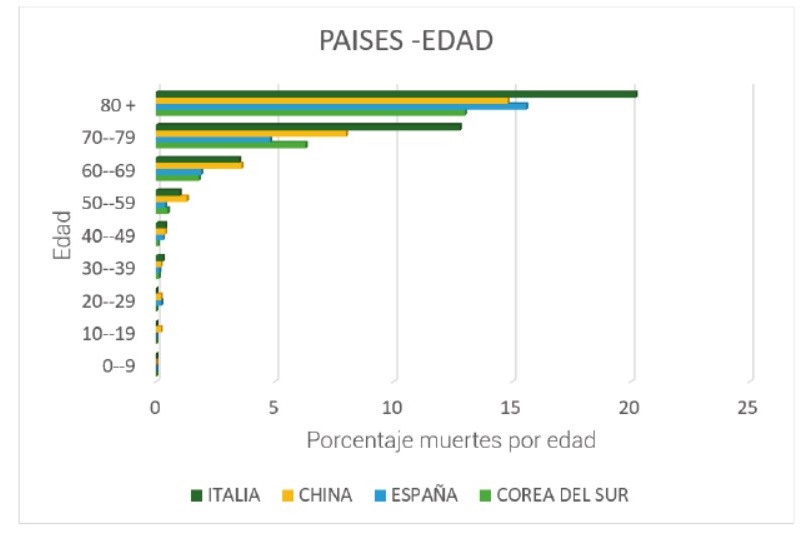
La enfermedad afecta de manera desigual por sexos dependiendo de la franja de edad (ver figura 5). En general la enfermedad presenta un pronóstico de gravedad moderada, solo alrededor del 1 % presentan cuadros clínicos graves (figura 6). La mayoría de los casos son incluso asintomáticos.
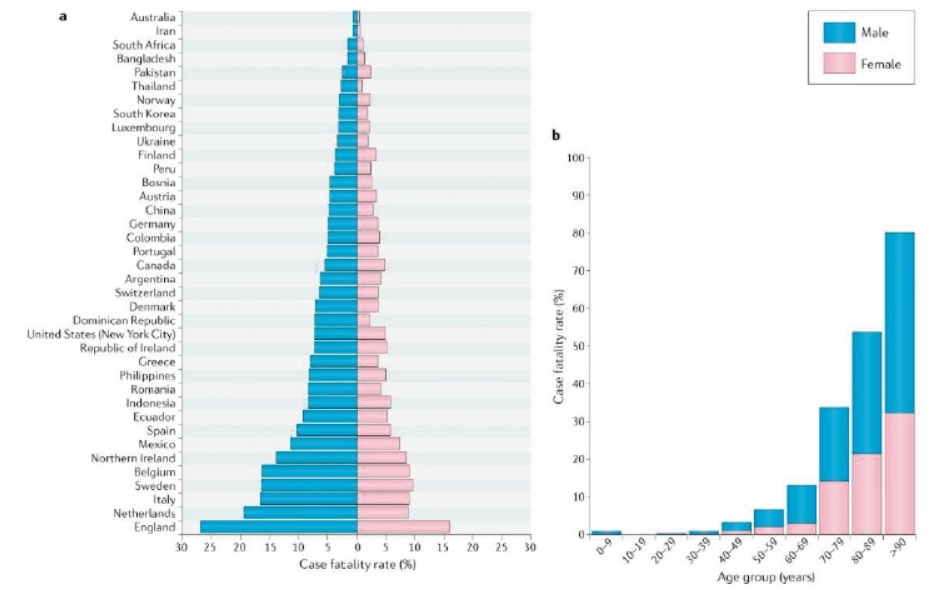
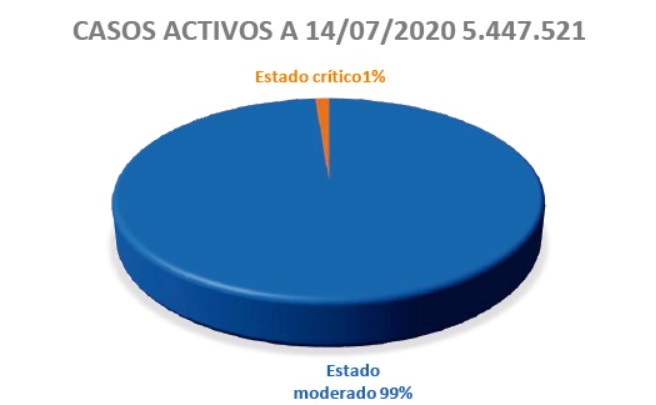
Figura 6. Del alrededor de 5,5M de casos activos solo 66.184 se encuentran en estado crítico
Según la organización mundial de la salud cada persona infectada, infecta a su vez, entre 1,4 y 2,5 personas (Statement on the meeting of the International Health Regulations (2005) Emergency Committee regarding the outbreak of novel coronavirus (2019-nCoV) - WHO, January 23, 2020) (este número se denomina técnicamente R0). Otros estudios determinan que R0 va de 2,24 a 4,0 (Z. Shao, 2020). Para tener criterios comparativos, el R0 de la gripe es 1,3 y del SARS fue 2,0.
Se estima que el 15 % de las personas hospitalizadas fallece (Huang et al., 2020). Aunque depende de la edad, el tiempo medio desde la aparición del primer síntoma hasta el fallecimiento, es de 14 días.
La media de permanencia en hospital es de 10 días (Weier Wang et al., 2020)
En diciembre de
2019, la ciudad de Wuhan, capital de la provincia china de Hubei, se convirtió
en el epicentro de un brote de una neumonía de origen desconocido. El 7 de
enero, ci chinos aislaron de pacientes infectos un
nuevo coronavirus, severe acute
respiratory syndrome coronavirus 2 (SARS-CoV-2) para el que, aunque es
probable que tuviese su origen en una trasmisión zoonótica
La clínica de la infección por SARS-CoV-2 es muy amplia, pudiendo presentarse cuadros leves, moderados o graves, incluyendo infección asintomática, enfermedad del tracto respiratorio superior leve, neumonía, con algunos pacientes desarrollando un síndrome de distrés respiratorio agudo (SDRA), sepsis y eventualmente evolucionando a un fallo multiorgánico y fallecimiento.
Características de la enfermedad
SARS-CoV-2 causa
una enfermedad severa en un 20 % de los pacientes, con una mortalidad de
aproximadamente el 3,7 %. Esto se debe en parte a una respuesta inmune
incontrolada frente a la infección por SARS-CoV-2 que desencadena una
híper-respuesta inflamatoria, que se corresponde con las características del
Síndrome de liberación de citoquinas (SLC), y que en casos graves evoluciona a
la denominada “tormenta de citoquinas”. La respuesta inflamatoria es un rápido
mecanismo de defensa frente a infecciones, que está estrictamente regulado por
una red de mediadores inflamatorios, incluyendo citoquinas como la IL-6. IL-6
es una citoquina pleiotrópica implicada en distintos mecanismos de la respuesta
inmune, teniendo un papel significativo en la inflamación. IL-6 es el principal
mediador en la fase aguda de la respuesta inmunitaria y en fiebre, habiendo
sido relacionada con estados inflamatorios patogénicos. Así, niveles elevados
de IL-6 son frecuentes en SLC, y correlacionan con la severidad y mortalidad en
sepsis. En particular, se ha demostrado que IL-6 está implicada en la “tormenta
de citoquinas” que sigue a la infección por Influenza H1N1 o SARS-CoV
Igualmente,
diversos estudios han reportado evidencias de coagulopatías asociadas a
COVID-19
Por otro lado,
según se ha ido avanzando en el conocimiento de la enfermedad, existe una mayor
evidencia sobre complicaciones cardíacas, como
miocarditis, arritmia e infarto de miocardio, en infecciones con SARS-CoV-2. El
daño cardíaco que deriva en estas serias complicaciones de la infección por
COVID-19 se pone de manifiesto con la alteración de varios biomarcadores, y en
particular con un aumento en los niveles de TnIc
En la figura 7 se han representado las enfermedades más frecuentes que presentan los enfermos de COVID según varios estudios clínicos.
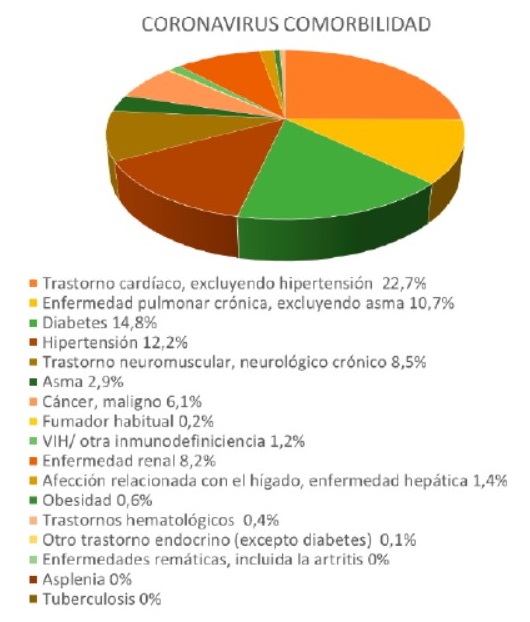
Figura 7. Datos de comorbilidad. Elaboración propia
Estrategias de control de la enfermedad
Las enfermedades infecciosas de tipo vírico se contrarrestan mediante las siguientes tres estrategias:
Fármacos. Se usan retrovirales que luchan para neutralizar el virus mediante distintas estrategias. Para el caso de COVID-19 se está usando de forma generalizada antivirales como oseltamivir y remdesivir (Beigel J.H 2020), junto con hidroxicloroquina y antagonistas de IL6 (Renyi Wu et al., 2020).
Vacunas. Este es el método más extendido para el tratamiento de enfermedades víricas. El método consiste en inocular una substancia del virus, puede ser una proteína, ácidos nucleicos o virus atenuados, para que el organismo genere anticuerpos neutralizantes de este y así se evite el desarrollo del virus y por tanto la enfermedad producida por este.
Inmunidad de grupo o rebaño. Consiste en la generación de anticuerpos de una manera natural, por toda la población a través de contactos generados en la vida rutinaria. Este método lo intentó, en primer lugar, Suecia y el Reino Unido con escasos resultados.
A continuación, se plantearán sumariamente de estas tres estrategias.
Desarrollo de un fármaco
El desarrollo de un nuevo medicamento se inicia normalmente cuando la ciencia fundamental descubre un objetivo biológico (por ejemplo, un receptor, enzima, proteína, gen, etc.) que está involucrado en un proceso biológico que se considera disfuncional en pacientes con alguna enfermedad.
Si se considera el caso de un descubrimiento completo de un nuevo fármaco, evidentemente muchas veces se parte de una molécula que ya ha demostrado eficacia en una enfermedad similar, en este caso el procedimiento se simplifica. Desafortunadamente muchas veces hay que hacer el desarrollo completo (Figura 8) l desarrollo de un nuevo fármaco sigue los pasos del siguiente esquema: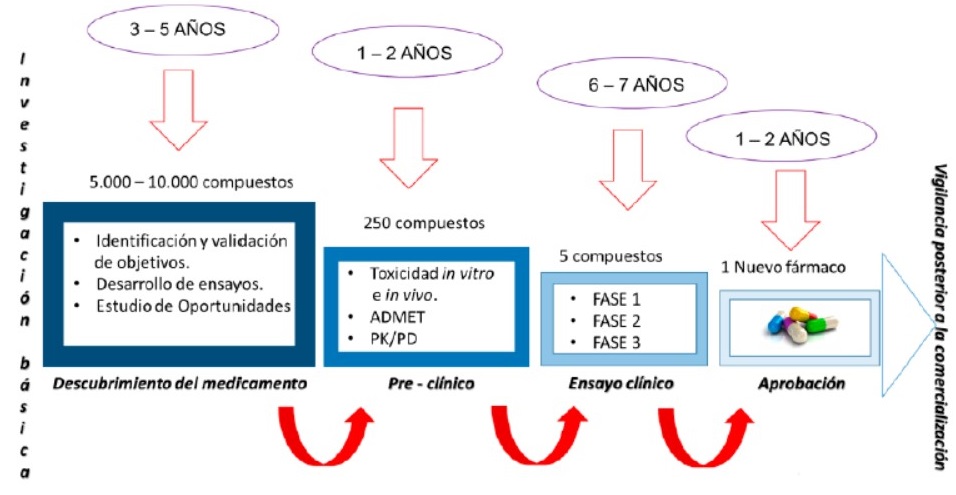
Figura 8. Esquema del desarrollo de un fármaco
ADMET (Absorption, Distribution, Metabolism, Excretion and Toxicity). PK/PD (pharmacokinetic/pharmacodynamic ). Fase I se comprueba si el fármaco es seguro. Fase II se analiza que el fármaco funciona. Fase III se estudian aspectos como la seguridad, la eficiencia y se compara con otros tratamientos
Una primera fase de investigación básica donde se determinan las causas de la enfermedad a nivel genético, proteómico y celular. A partir de estos estudios surgen las dianas a las que potencialmente las nuevas drogas deben dirigirse.
El proceso entonces consiste en:
• Validar estas dianas
• Descubrir la molécula correcta (fármaco potencial) para interactuar con estas diana
• Probar el nuevo compuesto en el laboratorio y la clínica por seguridad y eficacia
• Obtener la aprobación y poner el nuevo medicamento en manos de los médicos y pacientes.
La mala noticia es que este proceso dura en promedio alrededor de 15 años y cuesta en promedio 2.600 M$. (Drug Discovery and Development, Understanding the R&D Process. Available online: http://cmidd.northwestern.edu/files/2015/10/Drug_RD_Brochure-12e7vs6.pdf (accessed on 8 August 2016). Biopharmaceutical Research and Development, the Process Behind New Medicines. Available online:http://www.phrma.org/sites/default/files/pdf/rd_brochure_022307.pdf (accessed on 8 August 2016).
Como cifra indicativa por cada 10.000 moléculas que a nivel de I+D parecen tener buenas indicaciones terapéuticas, solo unas 250 entran en fase preclínica. De éstas, solo 6 inician clinical trials y de ellas solo 1 consigue ser aprobada. (JA Di Masi et al., 2010)
Este número incluye el coste de los miles de fracasos: por cada 5,000 - 10,000 compuestos que se investigan a nivel de I + D, en última instancia solo 1 recibe aprobación.
Actualmente, no existen vacunas o agentes terapéuticos eficaces comprobados contra el virus. El manejo clínico actual incluye medidas de prevención y control de infecciones y atención de apoyo, incluido oxígeno suplementario y ventilación mecánica de apoyo. La evolución de la investigación y los datos clínicos sobre el SARS-CoV-2 virológico sugieren una lista potencial de fármacos reutilizados con efectos farmacológicos apropiados y eficacia terapéutica en el tratamiento de pacientes con COVID-19. Los medicamentos más comunes y plausibles para el tratamiento de pacientes con COVID-19 son agentes antivirales (remdesivir, hidroxicloroquina, cloroquina, lopinavir, umifenovir, favipiravir y oseltamivir) y agentes de soporte (ácido ascórbico, azitromicina, corticosteroides, óxido nítrico, antagonistas de IL-6) (Renyi Wu et al., 2020). Estos son los medicamentos normalmente utilizados hasta que se desarrolle la vacuna o un fármaco específico.
Tormenta de citoquinas
Hay muchas evidencias que un subgrupo importante de pacientes graves de COVID-19 presentan un síndrome de tormenta de citoquinas. Las interleuquinas (un tipo de citoquinas) son un grupo de proteínas cuya funcionalidad consiste en dirigir a las células T ante la presencia de los patógenos para la generación de anticuerpos y por tanto para la destrucción de estos. La tormenta de citoquinas es una respuesta inmune incontrolada y en muchos casos letal de producción de citoquinas. Si esta tormenta se da en los pulmones, los fluidos y las células inmunitarias, (como los macrófagos), pueden llegar a acumularse y, en última instancia, obstruir las vías respiratorias, causando una neumonía muy grave que puede llevar a la muerte. Esta tormenta de citoquinas representa una es una de las principales causas de muerte del COVID19.
Una de estas citoquinas que se encuentra elevada en pacientes de COVID19 es la IL6, su monitorización es indicativa de complicaciones respiratorias.
Uno de los tratamientos recomendados para pacientes graves son moléculas inhibidoras de estas citoquinas como son corticoides o fármacos biológicos (anticuerpos monoclonales humanizados que se encargan de reducir la respuesta inmune) como el Tocilizumab o el Sarilumab
Anticoagulantes
Muchos datos refieren pacientes con elevados niveles de dimero-D, biomarcador característico de formación de trombos (Fuster V 2020) (Zhang Y, 2020). Se ha constatado que los anticoagulantes pueden mejorar la supervivencia de los pacientes con covid-19, al prevenir infartos o ictus
Plasma de convaleciente
Esta opción de tratamiento se refiere a la transfusión de plasma cargado con anticuerpos de individuos recuperados de la enfermedad. Esta técnica se ha utilizado durante décadas para otras enfermedades. La transfusión puede ofrecer una inmunidad inmediata a corto plazo para individuos. El plasma convaleciente puede usarse profilácticamente, y para pacientes ya infectados para atenuar su gravedad. El mecanismo de acción es a través de la unión de los anticuerpos transfundidos al patógeno. La biotecnológica Grifols está validando clínicamente este método. https://www.grifols.com/en/covid-19-plasma-therapies-clinical-in-trials#inactivatedconvalescentplasma
Inmunidad de grupo
Según varios estudios hechos en países con gran número de contagios, incluido España, solo alrededor del 5 % de la población actualmente es inmune, lo que indica que se está lejos de conseguir dicha inmunidad global. Además, todavía se desconoce la duración de la inmunidad, lo que dificulta más todavía esta estrategia. Por ello se prevén tres escenarios sobre el futuro de la evolución según el informe “The Future of the COVID-19 Pandemic: Lessons Learned from Pandemic Influenza” realizado por el grupo de investigadores del Centro de Investigación y Política de Enfermedades Infecciosas (CIDRAP) de la Universidad de Minnesota. En la figura 9 se distinguen tres tipos de escenario. Un primer escenario y tras un pico en el número de infectados vendrán otros brotes de menor cuantía (como en el caso de Corea del Sur). El segundo escenario revela que después de un evento y su disminución, llega el pico principal (como es el caso de Israel o EEUU). El último escenario sería aquel en el que todos los brotes son similares en cuantía (como Serbia o Japón). Como conclusión, esta enfermedad estará con nosotros de una manera más o menos controlada por un período de tiempo de varios años.
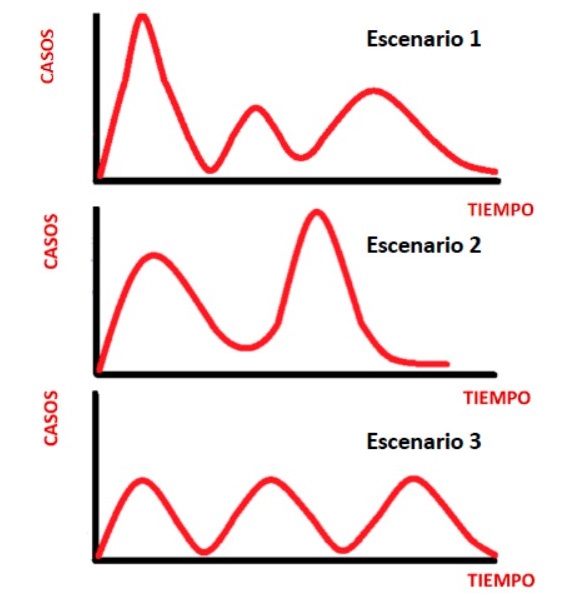
Figura 9. Posibles escenarios de la evolución de la pandemia
Como se observa en la figura 10 estos tres escenarios posibles se están ya verificando en algunos países
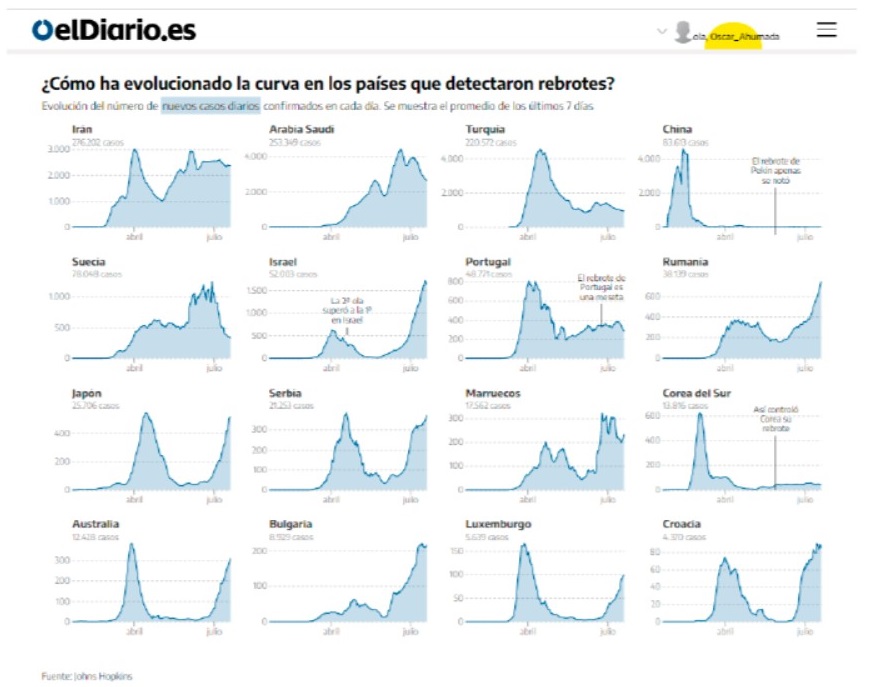
La inmunidad de rebaño ocurre cuando una gran parte de una comunidad (el rebaño) se vuelve inmune a una enfermedad, lo que hace poco probable la propagación de la enfermedad de persona a persona. Como resultado, toda la comunidad se protege, no solo aquellos que son inmunes.
A menudo, un porcentaje de la población debe ser capaz de contraer una enfermedad para que se propague. Esto se llama una proporción umbral. Si la proporción de la población que es inmune a la enfermedad es mayor que este umbral, la propagación de la enfermedad disminuirá. Esto se conoce como el umbral de inmunidad del rebaño.
Dada la transmisibilidad del SARS-CoV-2, y según un estudio publicado en el Journal of Infections es necesario que se contagie alrededor del 60 al 70 % de la población para poder alcanzar la inmunidad de grupo (Kwok K.O. 2020). En este estudio se estiman la proporción umbral de la población de distintos países a partir de la cual se obtiene la deseada inmunidad de rebaño.
Un estudio en España, publicado por la prestigiosa revista The Lancet, analizó la seroprevalencia en la población española (Pollán M. 2020). El estudio involucró a más de 61,000 personas y en el artículo se sugiere que es el estudio europeo más grande para verificar la seroprevalencia de los anticuerpos contra el SARS-CoV-2 realizado hasta ahora.
En este estudio todas las personas fueron evaluadas dos veces, una con una prueba rápida de punto de atención y otra con una prueba de inmunoensayo realizada en un laboratorio centralizado, con el fin de detectar la presencia de anticuerpos IgG en la sangre. Los anticuerpos IgG se forman más tarde en una infección y son responsables de la inmunidad a largo plazo.
Ambas pruebas buscaron diferentes antígenos de la cápside del virus SARS-CoV-2. El resultado del estudio fue que la seroprevalencia era solo del 5 % (número de personas que tenían anticuerpos contra el virus en la población). En concreto el valor estaba en el rango de 3.7 por ciento y 6.2 por ciento dependiendo de si se buscaba especificidad (resultado positivo en ambas pruebas) o sensibilidad (resultado positivo en una de las pruebas). El resultado más importante del análisis efectuada es por tanto que la inmunidad de grupo no es a corto plazo una solución para contener la pandemia.
Vacunas
Las vacunas representan generalmente el método más eficiente para tratar las enfermedades infecciosas producidas por virus. El proceso de desarrollar una vacuna es lento debido a las distintas fases por las que tiene que pasar desde el proceso de verificación hasta la aprobación por el ente regulador oportuno.
Aunque quizá esta vez los esfuerzos sean mayores y se consiga antes, el tiempo medio para el desarrollo de una vacuna es de 10- 15 años, como se muestra en el gráfico publicado por Rapuoli et al. en una retrospectiva sobre vacunas contra el HIV, la malaria y la tuberculosis (Figura 10) (Rapuoli R., 2011). Por eso, aunque algunos gobiernos están enfocados a obtener la inmunidad de grupo para frenar los contagios, que como hemos visto está lejos de poder conseguirse, el desarrollo de la vacuna se ha convertido en la principal apuesta de la OMS, de los gobiernos y de la ciencia para vencer esta pandemia.
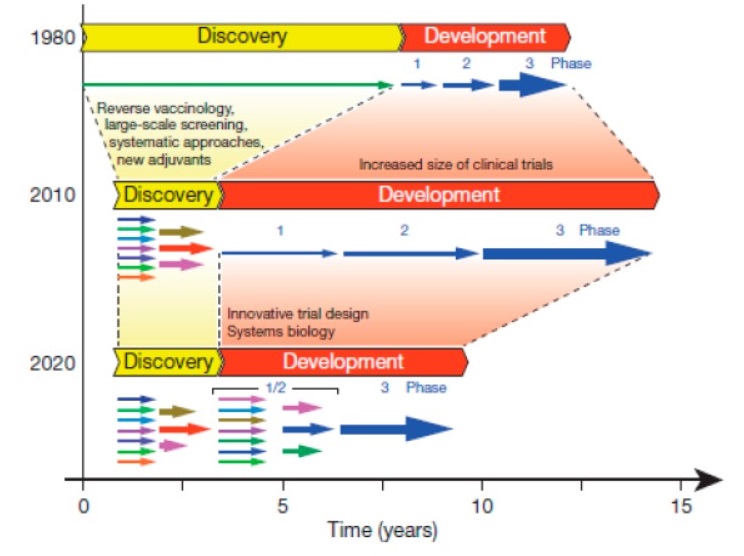
Figura 11. Tiempo de desarrollo de una vacuna (Rapuoli, 2011)
En la actualidad (julio 2020) hay 149 vacunas experimentales contra el COVID 19, de ellas 19 están en una de las tres fases de ensayos con humanos, según datos de la OMS.
Las más avanzadas son las siguientes.
Universidad de Oxford junto con su partner industrial Astra Zeneca. (UK)
Parece la más prometedora, al menos según los datos publicados en The Lancet el 20/07/2020 (Folegatti et al., 2020) donde se presentan los resultados de un primer estudio clínico que demuestra que la vacuna es segura y con alta tolerabilidad y que la posible reacción remite con paracetamol. La vacuna genera anticuerpos, activos en neutralizar proteínas del virus, después de una segunda dosis.
- Moderna (US). Esta vacuna es especial porque está basada en material genético en concreto en el micro RNA 1273
- CanSino Biologics (China). También publicaron en The Lancet los resultados de la fase I con un estudio en 108 adultos mostrando la su buena tolerabilidad y la capacidad de generar anticuerpos. (Feng-Cai Zhu et al 2020)
- Sinopharm (China)
- Sinovac Biotech (China) Sinovac ha anunciado que en breve iniciará estudios en fase III
- Instituto de Biología Médica de la Academia China de Ciencias Médicas (China)
- Imperial College de Londres (UK). Está desarrollando una vacuna basada en RNA y ha iniciado fase I y II.
- BioNTech/Pfizer/Fosun Pharma (Alemania-US). BioNTech ha publicado (preprint https://www.medrxiv.org/content/10.1101/2020.06.30.20142570v1.full.pdf) datos de seguridad de dicha vacuna también basada en RNA
- Inovio (US). Ha desarrollado una vacuna de DNA y espera iniciar ensayos fase II y III a finales de verano.
- Curevac (Alemania). El estado alemán ha adquirido el 23% de dicha compañía para asegurarse parte del control de la vacuna
Lo que nos espera.
A principios de año el virus tomó por sorpresa a la comunidad global y su curso futuro aún es altamente impredecible. Aunque predecir el futuro es difícil, los científicos siempre tenemos modelos aproximados que pueden dar cierta luz de lo que puede pasar, basándose en previas experiencias.
La epidemiología de otros coronavirus graves (SARS-CoV-1, el virus que causa problemas respiratorios agudos graves [SARS] y coronavirus del síndrome respiratorio de Oriente Medio [MERS-CoV]) es sustancialmente diferente de la del SARS-CoV-2; por lo tanto, estos patógenos no proporcionan modelos útiles para predecir qué esperar con esta pandemia.
Alternativamente según el estudio de la Universidad de Minnesota (CIDRAP) declara que el mejor modelo comparativo es el de la influenza o gripe. Desde principios de 1700, al menos ocho pandemias globales de influenza han ocurrido. Cuatro de ellas ocurrieron desde 1900, en 1918-19, 1957, 1968 y 2009-10. Podemos aprender potencialmente de las pandemias de influenza pasadas mientras se intenta determinar una visión para el futuro de la pandemia de COVID-19. Identificar similitudes y diferencias epidemiológicas entre COVID-19 y la influenza pandémica puede ayudar a visualizar varios escenarios posibles para el curso de la pandemia COVID-19.
Lo deseado, sería que después de un brote inicial y de alcanzar el máximo número de contagios se verificara una disminución continua de estos, de manera que no se produjeran nuevos brotes.
Como se ha comentado anteriormente la experiencia indica que mientras no haya solución (mediante inmunidad de grupo natural, o un tratamiento efectivo o con la aparición de una vacuna que inmunice a la población) surgirán nuevos brotes.
Cualquiera sea el escenario que siga la pandemia (suponiendo al menos algún nivel de medidas de mitigación en curso), debemos estar preparados para, al menos, otros 18 a 24 meses de actividad COVID-19 significativa, apareciendo puntos calientes periódicamente en diversas áreas geográficas.
Aunque la pandemia disminuya, es probable que el SARS-CoV-2 continúe circulando en la población humana y siga un patrón estacional con severidad que disminuirá con el tiempo, como con otros coronavirus menos patógenos, como los betacoronavirus OC43 y HKU1, (Kissler 2020) y el virus de influenza. Kissler sugiere que distanciamiento social prolongado o intermitente puede ser necesario hasta al menos el 2022. La llegada de la ansiada vacuna será la solución definitiva y el fin de la pandemia.
Diagnóstico
El diagnóstico del COVID-19 se realiza mediante la técnica de PCR (Reacción en Cadena de Polimerasa) que detecta el RNA del virus. Evidentemente tratándose de un virus respiratorio donde mayor concentración del virus hay, es en el tracto respiratorio, la muestra que se utiliza para la detección es de esputo o de fluido nasofaríngeo recogida mediante un bastoncillo (https://youtu.be/DVJNWefmHjE). Posteriormente hay un proceso de extracción del RNA. El test tiene un coste de entre 10 y 15 € y la tecnología de lectura, el termociclador, entre 3.000 y 90.000 € según la complejidad de este. El tiempo para el resultado es entre 2-5 horas.
Algunos estudios sugieren que este método presenta sensibilidad clínica limitada y posibles falsos negativos (Zhou, P. Nature 2020, 579 (7798), 270-273). Los falsos negativos pueden deberse a una baja carga viral en el momento del análisis, errónea extracción de la muestra, problemas de procesado o transporte.
Estos test de PCR se combinan con test serológicos para estudiar el estado de la infección o tener información sobre el estado de inmunidad del paciente. No hay evidencias hasta la fecha de que ser positivo en test de serología indique protección inmune.
La potencia y duración de la inmunidad, son variables indispensables para tomar decisiones sobre cómo actuar con relación a medidas de confinamiento. En sistemas parecidos como el SARS-CoV o el MERS-CoV se ha demostrado que los anticuerpos circulantes tienen una duración de entre 12 y 24 meses. Sin embargo, un estudio realizado por Long Q. et al. y publicado en Nature Medicine (Long Q. 2020) demuestran que en el caso del COVID-19 los niveles de IgG y de los anticuerpos neutralizantes empiezan a disminuir después de 2 ó 3 meses de la infección. Aunque la muestra del estudio es de solo 37 pacientes, no son noticias esperanzadoras sobre la duración de la protección contra el virus.
Datos sobre test rápidos de detección serológica publicados en varios estudios reclaman que estos test presentan niveles elevados, tanto de falsos positivos como de falsos negativos (M. L. Bastos 2020) y por lo tanto no son de gran utilidad a la hora de otorgar un pasaporte de inmunidad a las personas que den positivo (presencia de anticuerpos) en dichos test, con el fin de permitir la libre movilidad de dichas personas. Además, en caso de presentar anticuerpos, no se sabe a ciencia cierta la duración de la protección de los mismos.
Modelo matemático de crecimiento natural de una infección vírica
La forma matemática de cómo se propaga una pandemia es la siguiente:


Esta es una función exponencial y de ahí su rápido
crecimiento. Pongamos un ejemplo para evidenciar como es el crecimiento.
Supongamos que (1+Cp)=1,5
Evidentemente la única variable sobre la que se puede afectar
para reducir este ascenso es
La figura 12 representa la variación de ρ = 1 + Cp, descrito anteriormente, a lo largo del tiempo en el mundo. Se observan dos máximos, en el primer caso ρ alcanza un valor mayor que en el segundo. Esto puede deberse a que: en el primer pico hablamos prácticamente sólo de los casos en Wuhan y que el segundo se corresponde con los casos registrados fuera de China, en países que ya conocían el virus. Además, siguiendo la fórmula descrita se observa que el crecimiento diario en número de casos para alcanzar un ρ similar al del primer pico debería ser notablemente mayor que en el caso inicial puesto que hay un mayor número de afectados junto con la aparición de medidas sanitarias que facilitaron el control del virus. En la figura 13 se describe el descenso de casos en distintos países.
Se han seleccionado algunos de los que 20
países con más casos a día 07/07/20 que ya
hubieran experimentado un descenso notable en el número de
casos, es por ello por lo que países como Perú, Chile,
India o Brasil no aparecen.
En la gráfica destaca Nueva Zelanda que desciende
rápidamente. Esto se debe a sus políticas de cierre de
fronteras en los estadios iniciales de la pandemia junto con un
posterior aislamiento, por lo que ha alcanzado escasos 1186 positivos.
En el centro de la gráfica se observa el decrecimiento de Reino Unido, Italia,
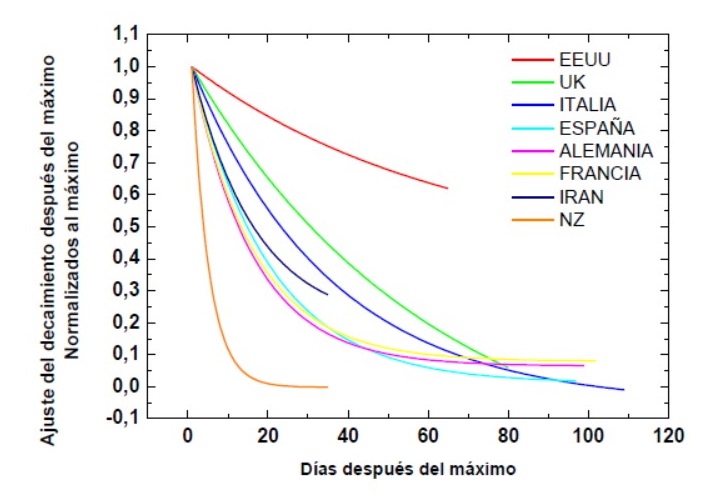
España, Alemania y Francia que tienen un comportamiento similar entre ellas, un decaimiento exponencial con fórmula
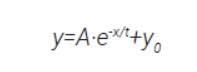
Este comportamiento similar se debe a que se tomaron unas medidas sanitarias similares en todos estos territorios (recordar que las curvas están normalizadas, por ello no significa que estos países hayan tenido un número similar de casos, sino que las medidas aplicadas producen un descenso de este tipo).
En cuanto al caso de Irán, se observa cómo tomó unas medidas similares inicialmente, pero al interrumpir antes sus medidas sanitarias dio lugar a un nuevo rebrote (como se ha podido observar, pues los datos son posteriores a la escritura de este artículo).
Finalmente destaca el caso de EEUU con una pendiente notablemente menor al resto de países pues se han tomado unas medidas sanitarias más laxas junto con una interrupción temprana de las mismas que nuevamente han dado lugar a un rebrote.
REFERENCIAS BIBLIOGRÁFICAS
- Alijotas-Reig, J. (2020). Immunomodulatory therapy for the management of severe COVID-19. Beyond the anti-viral therapy: A comprehensive review. Autoimmun Rev.19 (7), 102569.
- Arachchillage, D. (2020). Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J. Tromb. Haemost., 18, Issue 5
- Beigel, J. H. (2020). Remdesivir for the Treatment of Covid-19 — Preliminary Report. N Engl J Med
- Bikdeli, B. (2020). COVID-19 and Thrombotic or Thromboembolic Disease: Implications for prevention, antithrombotic therapy, and follow-up. JACCS. J Am Coll Cardiol. 2020;75(23):2950-2973
- Chen, N. (2020). Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. The Lancet, 395, 507-513.
- Chen, X. (2020). Detectable serum SARS-CoV-2 viral load (RNAaemia) is closely correlated with drastically elevated interleukin-6 (IL-6) level in critically ill COVID-19 patients. Clin infect Dis.2020:ciaa449
- CIDRAP The Future of the COVID-19 Pandemic: Lessons Learned from Pandemic Influenza Coronavirus disease (COVID-19) Pandemic. (2020, May 18). Retrieved from WHO: https://www.who.int/emergencies/diseases/novel-coronavirus-2019.
- Danzi, G. B. (2020). Acute pulmonary embolism and COVID-19 pneumonia: a random association? European Heart Journal 41, 19, 1858, 2020.
- DiMasi, J. A. (2010). Trends in Risks Associated With New Drug Development: Success Rates for Investigational Drugs, Clinical pharmacology & Therapeutics, 87, 3
- Fogarty, H. (2020). COVID-19 coagulopathy in Caucasian patients. Br J Haematol.
- Folegatti, P. (2020). Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial, The Lancet
- Fu, B. (2020). Why tocilizumab could be an effective treatment for severe COVID-19. J Transl Med, 18, 164-169 (2020)
- Gao, Y. (2020). Diagnostic utility of clinical laboratory data determinations for patients with severe COVID-19. J. Med. Virol., 92 (7), 1-6.
- Gaze, D. C. (2020). On the clinical utility of cardiac Troponin measurement in COVID-19 infection. Annals of Clinical Biochemistry: International Journal of Laboratory Medicine. Ann Clin Biochem 57 (3) 202-205
- Guzik, T. J. (2020). COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc Res. 2020;116(10):1666-1687.
- Herold, T. (2020). Level of Il-6 predicts respiratory failure in hospitalized symptomatic COVID-19 patients. medRxiv, preprint.
- Huang, C. (2020). Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395, 497-506.
- Kwok, K. O. (2020). Herd immunity – estimating the level required to halt the COVID-19 epidemics in affected countries. J Infect., 80 (6), e32-e33.
- Kissler, S. (2020) Projecting the transmission dynamics of SARS-CoV-2 through the postpandemic period. Science, 368, Issue 6493, 860-868.
- Lillicrap, D. (2020) Disseminated intravascular coagulation in patients with 2019- nCoV pneumonia. J Thromb Haemost ,18(4),786-787
- Lisboa, M. (2020) Diagnostic accuracy of serological tests for covid-19: systematic review and meta-analysis BMJ 2020;370:m2516
- Long, Q. (2020). Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med
- Mehta, P. (2020). COVID-19: consider cytokine storm syndromes and immunosuppression. The Lancet, 395, 1033-1034.
- Ministerio de Sanidad. (2020). Información científica-técnica. Enfermedad por coronavirus, COVID-19. Centro de Coordinación de Alertas Sanitarias, 17 de abril.
- Mulligan, M. (2020) Phase 1/2 Study to Describe the Safety and Immunogenicity of a COVID-19 RNA Vaccine Candidate (BNT162b1) in Adults 18 to 55 Years of Age: Interim Report, Medrxiv, preprint
- Munster, V. J. (2020). A novel coronavirus emerging in China - key questions for impact assessment. N Engl J Med, 382, 692-694.
- Paquette, S. G. (2012). Interleukin-6 is a potential biomarker for severe pandemic H1N1 Influenza A Infection. PLoS ONE, 7, e38214.
- Paranjpe, I. (2020). Association of treatment dose anticoagulation with In-hospital survival among hospitalized patients with COVID-19. . J Am Coll Cardiol., 76, Issue 1,122-124
- Phua, J. (2020). Intensive care management of coronavirus disease 2019 (COVID-19): challenges and recommendations. Lancet Respir Med, 8, 506–517
- Pollán, M. (2020). Prevalence of SARS-CoV-2 in Spain (ENE-COVID): a nationwide, population-based seroepidemiological study The Lancet July 06, 2020
- Rapuoli, R. (2011). A 2020 vision for vaccines against HIV, tuberculosis and malaria Nature 2011, 273, 463.
- Ruan, G. (2020). Clinical predictors of mortality due to COVID-19 based on analysis of data of 150 patientes from Wuhan, China. Intensive Care Med. 46 (5), 846-848.
- Scully, E. (2020). Considering how biological sex impacts immune responses and COVID-19 outcomes Nat Rev Immunol, 20, 442-447
- Zhao, S., Lin, Q., Ran, J., et al. Preliminary estimation of the basic reproduction number of novel coronavirus (2019-nCoV) in China, from 2019 to 2020: A data-driven analysis in the early phase of the outbreak. Int J Infect Dis. 2020; 92:214-217.
- Tang, N. (2020). Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J. Thromb. Haemost., 18, 844-847.
- Wang, W. (2020). Updated understanding of the outbreak of 2019 novel coronavirus (2019-nCoV) in Wuhan, China. J Med Virol, 92, Issue 4, 441-447.
- Wu, R. (2020). An Update on Current Therapeutic Drugs Treating COVID-19. Curr Pharmacol Rep, 6,56-70
- Zhang, Y. (2020). Coagulopathy and Antiphospholipid Antibodies in Patients with Covid-19, N Engl J Med 2020; 382: e38 ) 17) e38
- Zhao, S. (2020). Preliminary estimation of the basic reproduction number of novel coronavirus (2019-nCoV) in China, from 2019 to 2020: A data-driven analysis in the early phase of the outbreak, International Journal of Infectious Diseases, 92, 214-217
- Zhou, F. (2020). Clinical course and risk factors for mortality of adult in patients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet, 395, 1054-62.
- Zhou, P. (2020). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 579, (7798) 270-273.
- Zhu, F. (2020). Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial, The Lancet July 20.
Los autores agradecen las discusiones con la Dra. Virginia Cebrián, la Dra. Noemí Marina y la Dra. Paola Gialanella que sin duda han contribuido notablemente en la escritura de este manuscrito. También agradecemos a Isabella Ahumada por la realización da algunas figuras que ayudan al mejor entendimiento de los datos.